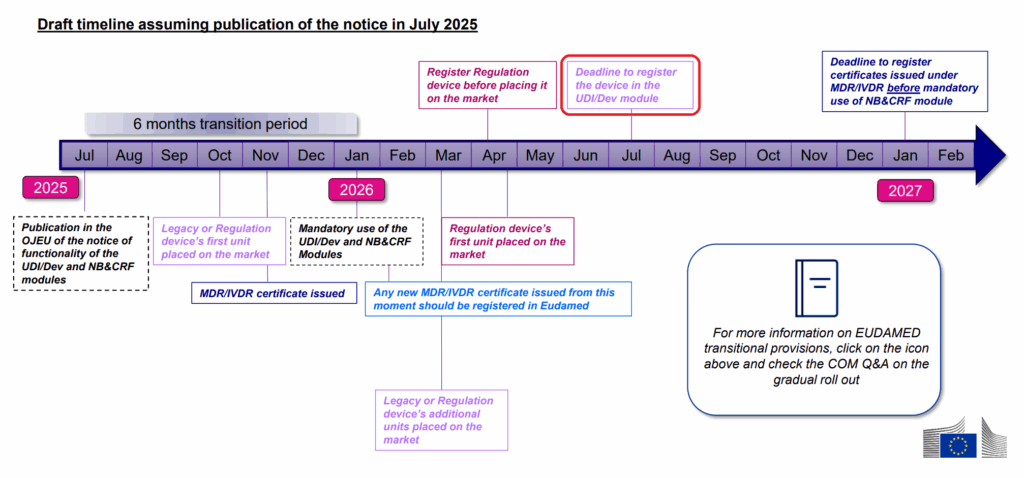
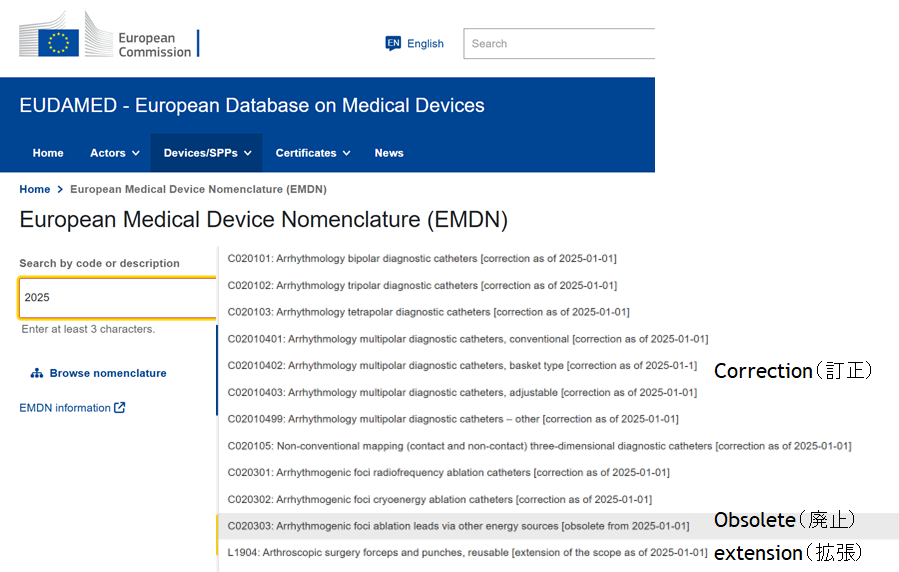
2024年7月にEUオフィシャル・ジャーナル(Regulation (EU) 2024/1860)公布により、EUDAMEDは各モジュールごとに利用開始(=登録期限)をEU側で設定できるようにMDR/IVDRの改正が行われました。「UDIデバイス登録」と「NB認証」モジュールは、早ければ2026年1月に登録期限が設定される可能性となり、EUDAMED公式サイトのタイムラインにも同様のスケジュールが掲載されています。
リスククラスIIb、IIIの高リスク製品では、医療機器メーカーが、「UDIデバイス登録」モジュールでEUに提出後(サブミットといいます)、ノーティファイド・ボディが「NB認証」モジュール内で、証明書の確認、承認作業を行なわないと、EUDAMED上のステータスが「REGISTERED(登録済)」にはならないため、医療機器メーカーとNBの連携した作業が必要となります。2024年8月現在で、残された期間は17ヶ月強ありますが、NB側の認証作業の期間を考慮すると、医療機器メーカー側の準備、登録作業の時間は、そう多くは残されておりません。
ヘルスケア分野向け専門セミナーを企画・運営している「(株)情報機構」様の「会場セミナー」にて、UDI登録の課題に取り組む企業様向けに、弊社担当で下記のセミナーを実施させていただく予定となりました。詳細及び申込はリンク先をご参照ください。
――――――――――――――――――――――――
★2024年11月26日(火) 13:00-16:30★
EUDAMED(欧州医療機器データベース)におけるMDR/IVDR製品・レガシーデバイス等のUDIデータ登録を期限内に提出するために押さえておきたい準備・手順・要求事項【国内医療機器メーカーの事例を元に解説】
EUDAMED UDI登録セミナー:2024年11月26日(火) 13:00-16:30 :場所【東京・大井町】きゅりあん4階
EUDAMEDへUDI登録を実施するにあたって、DTX接続環境での登録作業の経験を元に、EUDAMEDの最新状況、UDI登録準備を進めるにあたっての注意点を解説するとともに、テストサイト上に登録したデータ実例の紹介や、DTX登録のデモンストレーション、各国UDI登録システムの最新状況等にも触れ、EUDAMED UDI登録に関する理解を深め、実践に役立つセミナーとなるよう準備を進めています。会場実施の利点を活かし、個別のご質問等にも可能な限り対応していきたいと考えております。
――――――――――――――――――――――――
今回のセミナーは会場実施のみとなります。(ZOOMによる配信は行いません)
受講申込にあたり、受講料が「11,000円引き(税込)」となる講師紹介割引コードがあります。申込の際に
【講師紹介割引番号:B-012】
をご利用ください。また、1社2名様以上で受講の場合は、講師紹介割引と同時申込割引を併用できますので、1名様につき「13,200円引き(税込)」となります。
◆IVDD製品期限延長、EUDAMED利用必須時期のルール改正に関する投稿はこちらからどうぞ◆
IVDD製品期限延長とEUDAMED段階利用の改正提案・・・ 延長期限日程と、EUDAMEDスケジュールについて
IVDD製品期限延長とEUDAMED段階利用の改正提案(2)・・・ Regulation (EU) 2024/1860公布と、EUDAMEDロードマップ更新