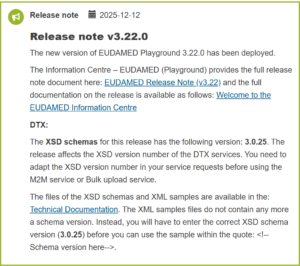
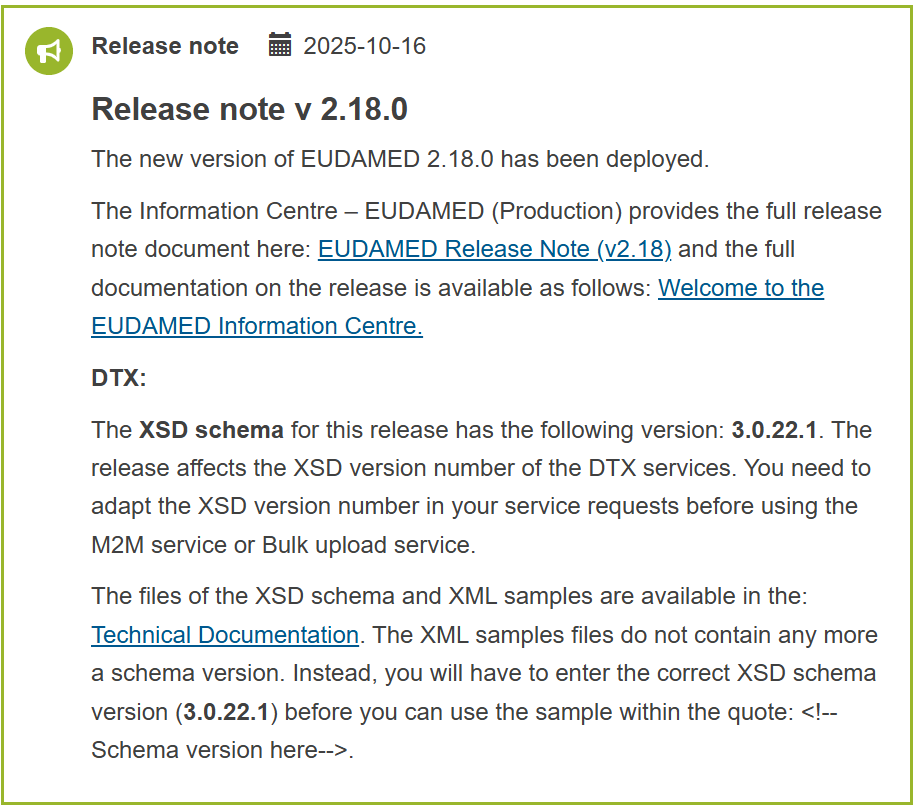
EUDAMED PRODUCTION(本番)サイトは、2026年1月27日付のメンテナンス作業により、v2.22.0 が公開されました。2025年12月に更新されたテスト環境(Playground v3.22.0)の変更内容を受けての更新となります。リリースノートは、こちらから確認できます。
主な更新箇所は以下となります
- XSDスキーマバージョンが更新されました(v3.0.25)。PlaygroundのXSDスキーマバージョンとの整合性がとられました。v3.0.25に対応したXMLサンプルファイルがテクニカル・ドキュメンテーションにアップされています
- データディクショナリ(UDI)、UDIモジュールのユーザーガイドなどの関連資料が、v2.22.0用として更新されました
- EMDNコードがv3に更新されました、一覧リストはこちらからダウンロードできます
今回の更新では、XMLファイル書式に関するスキーマバージョンが更新され、XSD v3.0.25となりました。テスト環境と本番環境が同一スキーマを使用できるため、テストで使用したXMLデータをそのまま本番環境で適用できるようになりました。今回のバージョンアップで、DTX接続に関するバグ修正が実施され、一部メッセージルールの変更も加えられています
尚、今回のバージョン更新はv2.xxのままのため、MF(製造事業者)が利用可能なVigilance(市販後調査)モジュールのリリースは見送られています。MFロールで利用できるモジュールは、以前と変わらずActor(アクター)とUDI(デバイス)の2モジュールとなります。(Certificate(NB/認証)モジュールは閲覧のみ可)
◆Playground v3.22.0 リリースについての投稿はこちらからどうぞ◆