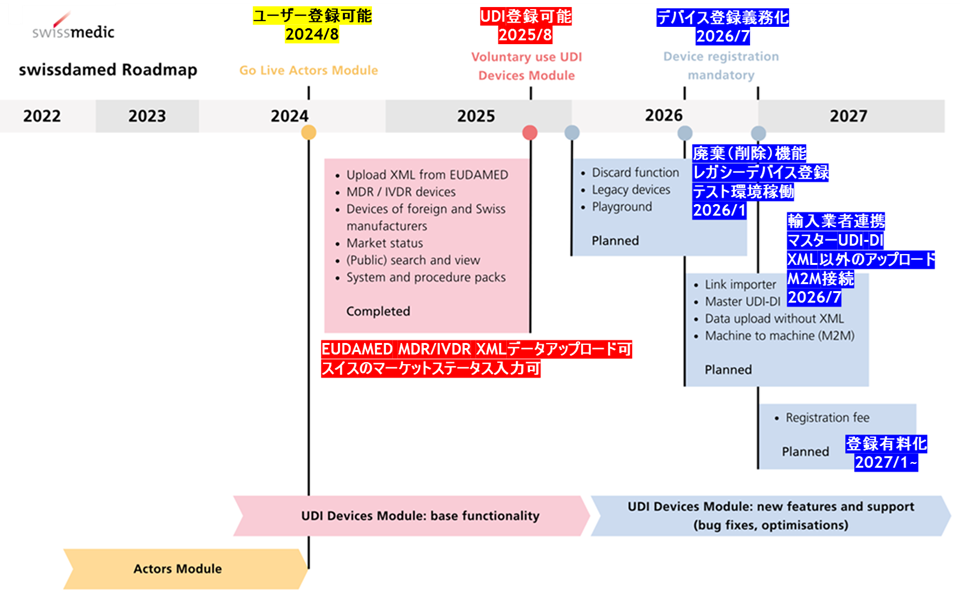
スイス所在の製造事業者、システム/プロシジャーパック事業者、代理人企業は、スイスで販売する医療機器のUDIデバイス情報を、「swissmedic」が運営する「swissdamed(スイスダメッド)」への登録が義務化されます。2025年11月時点での「swissmedic」からの発表スケジュールでは2026年7月からUDIデバイスの登録義務化が始まります。
一方、2025年8月に稼働したUDIデバイスモジュールでは、「EUDAMED」、「GUDID」のようなWEBアプリによる登録画面は用意されておらず、XMLファイルアップロードのみの提供となっています。XMLの書式は、「EUDAMED」で使用するXSD形式と同一で、相違点は、以下の4つと発表されています
- スイスにおけるマーケット(販売)ステータス
- CHRN(アクター番号)
- スイスの代理人情報
- 「swissdamed」のバージョン情報
「EUDAMED」のXSD形式のXMLファイルを取り扱うことができれば、「swissdamed」への登録は指定画面からXMLファイルをアップロードするだけで完了しますが、「EUDAMED」へ登録していないスイス向け製品については、別途XMLファイルを用意しないと対応できません。「EUDAMED」へ登録後、XMLファイルをダウンロードしてから、必要事項を修正するという作業を「swissdamed」は推奨していますが、デバイス数が多ければ、1デバイスごとに手作業での修正が発生するため、M2M接続による送信(「EUDAMED」のDTX接続と類似した方法)の確立が求められます。「EUDAMED」でDTX接続サービスを提供するドイツBYRD.Health(バード・ヘルス)社では、「swissmedic」と共同で、M2Mの接続テストを実施中です。「swissdamed」のM2M機能対応は、2026年7月を予定しているため、そのタイミングでのサービス提供を計画し、現在テストを実施しています。
◆BYRD. Health社に関連する記事はこちらからどうぞ◆
BYRD Health始動・・・DTX事業者 BYRD.Health(osapiens)社サービスのご紹介