2024年2月14日のEU理事会で承認された、IVDDの期限延長、及びEUDAMEDの段階利用に関する、MDR/IVDRの法改正案は、4月25日にEU本会議で可決され、7月9日付でEUオフィシャル・ジャーナルとして公布されました(Regulation (EU) 2024/1860)。オフィシャルジャーナルの該当ページはこちら。
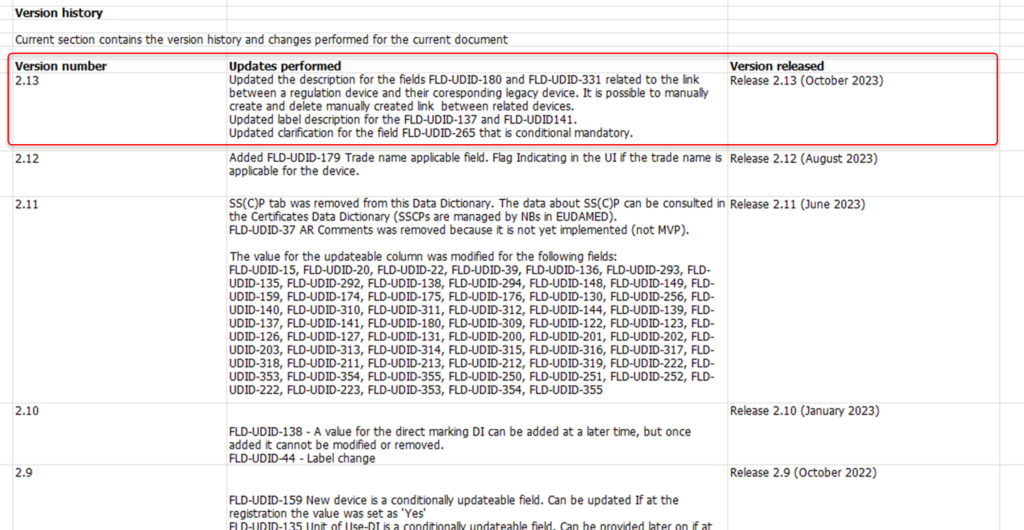
改正内容の詳細は、こちらページに記載された内容と同一です。EUDAMEDに関する大きな変更点は、これまで6つ全てのモジュールがリリースされ、EU監査完了→オフィシャル・ジャーナル公布後、「UDIデバイス」と「NB認証」以外は6ヶ月後から必須、「UDIデバイス」と「NB認証」はさらにプラス18ヶ月後から必須となっていた利用開始(=登録期限)が、各モジュールのEU監査完了→オフィシャル・ジャーナル公布後、12ヶ月以内の登録が義務化されます。対象はMDR/IVDRの新規則製品のみならず、市場流通しているレガシーデバイスも対象となります。証明書の登録は、公布後18ヶ月以内の登録期限となります。
※追記※
2024年7月10日付で、EUDAMEDの公式サイトにある、「TimeLine(タイムライン=各モジュールのリリーススケジュール)」資料が更新されました。2025年7月に、「アクター登録」、「UDIデバイス」、「NB認証」、「市場監視(MSU)」の4モジュールを、「EUオフィシャル・ジャーナル」で公示予定となり、これにより2026年第1四半期(1-3月期)より、利用開始となることが公表されました。レガシーデバイス含む、EU市場で流通しているすべての製品のUDI登録が決まったことで、クラスIIb、IIIの「NB認証」作業も今後進んでいくものと思われますが、医療機器メーカー各社様の早期の対応が望まれます。
また、「市販後調査(Vigilance)」については、2026年1月に「EUオフィシャル・ジャーナル」で公示予定となり、2026年第3四半期(7-9月期)より、利用開始となることが併せて公表されています。
さらに、2024年11月に「GRADUAL ROLL-OUT OF EUDAMED(EUDAMEDの段階的利用について)」と題するQ&A集が公開されました。UDI/デバイスモジュールに関するQ&Aは、Q7-9に記載されています。
注目は「Q7. When will the use of the UDI/DEV module become mandatory?(UDI/デバイスモジュールはいつから利用必須となりますか?)」の回答部分です。青字で記載された例では、2025年7月1日にOJEU(オフィシャルジャーナル)が公布された場合、6ヶ月後の2026年1月1日から利用必須となります。利用必須日以降に販売されるデバイスは、EUDAMED UDI登録が無いとMDR/IVDRに準拠できていない状態となります。また、2026年1月1日時点で販売されているものは、2026年7月1日(さらに6か月の猶予)までに、EUDAMED UDI登録が完了していないとMDR/IVDRに準拠できていない状態になるとの記載があります。
◆IVDD製品期限延長に関する投稿はこちらからどうぞ◆
IVDD製品期限延長とEUDAMED段階利用の改正提案・・・ 延長期限日程と、EUDAMEDスケジュールについて