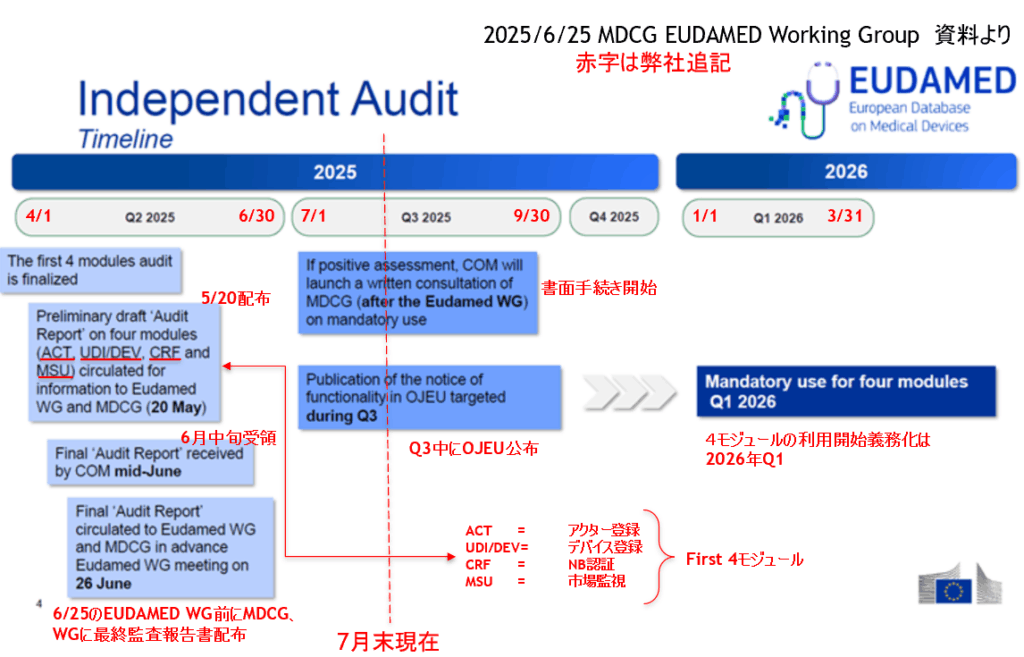
2025年5月にドイツ・シュツットガルトで開催されたEUDAMED WORKSHOPでの説明では、2025年7月にOJEUが公布され、EUDAMED利用開始時期と、登録期限が決定するとありましたが、7月末現在で、OJEUの公布は確認できておりません。
一方、2025年6月末に開催された「MDCG EUDAMED WORKING GROUP」では、MDR/IVDRの最小要件を満たす(MVPと表現されています)先行4モジュール「アクター登録、UDIデバイス、NB認証、市場監視」の最終監査報告が、MDCGと、EUDAMED WGに提出され、OJEU公布に向け書面手続きを実施していることが確認されました。また、資料ではOJEUは7月予定から、Q3(7月から9月末までの第3四半期)予定に公布時期が変更されていることが確認できます。予定より2ヶ月程度の遅延が見込まれますが、9月末までの公布された場合は、UDIデバイスの登録開始は、2026年3月末から、また、開始日(3月末)前に上市された製品は、2026年9月末までの登録が義務化されます。
UDIデバイス登録は、製品情報を正しくマーケットに伝えることが目的のため、医療機器製造事業者は、正確なデータ項目の設定が求められています。製品構成によっては、どの項目に、どの値を設定すれば良いのかといったことで悩まれている企業様も多く見受けられます。EUMDAEDの要求項目は多岐にわたりますので、事前の準備、項目の整理等を実施した上で、登録作業に着手されることをお勧めします。
◆IVDD製品期限延長、EUDAMED利用必須時期のルール改正に関する投稿はこちらからどうぞ◆
IVDD製品期限延長とEUDAMED段階利用の改正提案・・・ 延長期限日程と、EUDAMEDスケジュールについて
EUDAMED WORKSHOP・・・5/21ドイツ・シュツットガルトでオンライン、オンサイト同時開催セミナーについて

