2023年10月 EUDAMEDモジュールのリリース時期、登録期限などに関する変更の案内が発表されました。今回の発表では、ドラフト(下書き)版としての公開ですが、EU加盟国の各管轄当局(CA)とスポンサー(SP)向けモジュールである「臨床調査とパフォーマンス研究(Clinical Investigation & Performance Study(CI&PS))」が、「2026年第3四半期(7-9月期)」までリリース延期される見込みとの内容です。一方、UDIデバイス登録、NB認証含む残りの5モジュールについては、「2024年第2四半期(4-6月期)」 までにリリースされる予定で、欧州委員会の監査も「2025年第1四半期(1-3月期)」までに完了する見込みとなっています。
EUDAMED全モジュールの期限は、6モジュールすべての監査完了(今回発表されたタイムラインでは、「2027年第1四半期」)し、EU官報に掲載(同、「2027年第2四半期」)されてから、①アクター登録、④臨床調査、⑤市販後調査、⑥市場監視モジュールは6ヶ月間の移行期間、②UDI登録、③NB認証は、6ヶ月+18ヶ月後の24ヶ月間を移行期間とすることが法律で定められているため、「臨床調査とパフォーマンス研究」モジュールのリリース遅れは、全体スケジュールに影響を与えることとなります。
製造事業者(MF)、システム&プロシジャーパック事業者(PR)が利用する、「①アクター登録」、「②UDI登録」、「⑤市販後調査(Vigilance)」モジュールの全機能は、来年(2024年)中頃には利用できる予定ですが、UDI登録作業含む、製造事業者の利用に影響を与える可能性も考えられます。
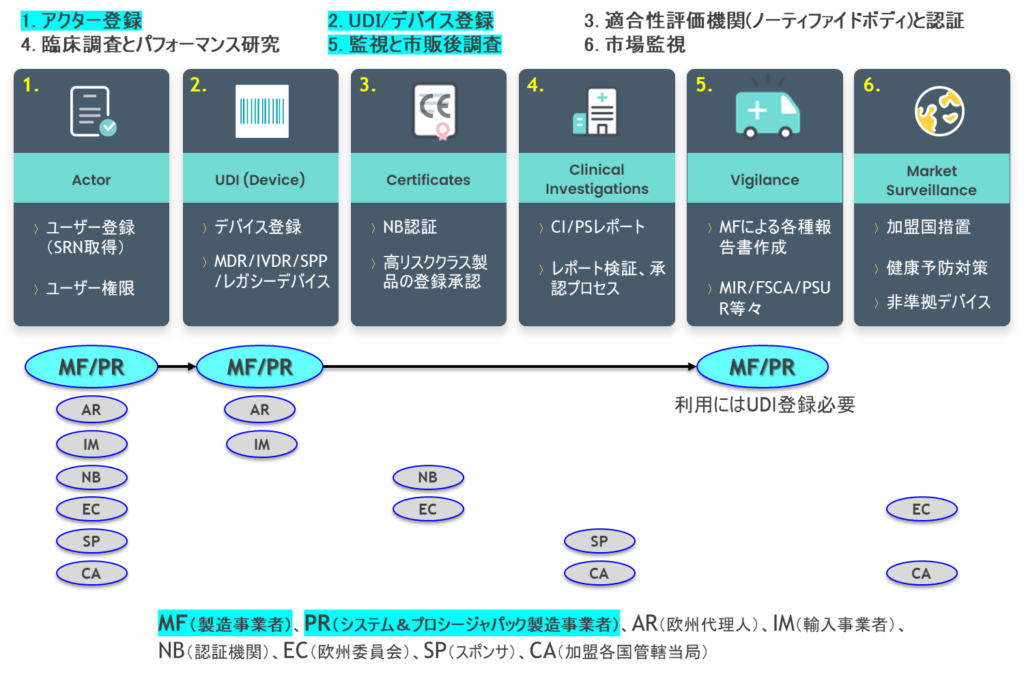
EU全体での動きとしては、MDR/IVDRの法律に則り、上記スケジュールとなりますが、一方で、ドイツは、すでにアクター登録によるSRN番号の取得、アイルランドの管轄当局は、リスククラス1の医療機器と、IVDの通知は、「EUDAMED経由で提出」を要求するなど、加盟国、管轄当局によってEUDAMEDの利用度合い(義務化)が異なっています。さらに、国内で医療機器データベースをすでに運用しているイタリア、ハンガリーなどは、既存システム(MDR/IVDR未対応)をいつまで維持するのかの判断を迫られている状況に変わりはありません。
医療機器メーカーがEUDAMEDにUDI登録するきっかけとなるイベントとしては、
- MDR/IVDR製品の認証取得時
- レガシーデバイスの延長手続き完了時
- PSUR「定期的安全性最新報告書」作成時
- インシデント・レポート作成時
などが考えられますが、UDI登録の必要度合いは、EU全体のスケジュールだけではなく、販売(流通)市場が、EU加盟27か国及び、EFTA加盟国、イギリス領北アイルランド、トルコなど対象となる国・地域により異なります。いずれにしても、UDI登録に必要な項目理解やデータ収集などの登録準備に、一定期間が必要となることは従来通りとなります。

