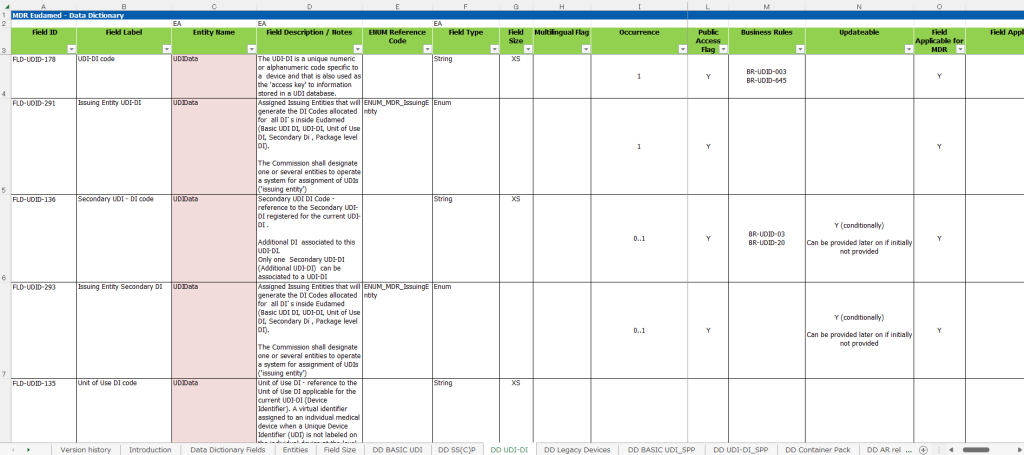
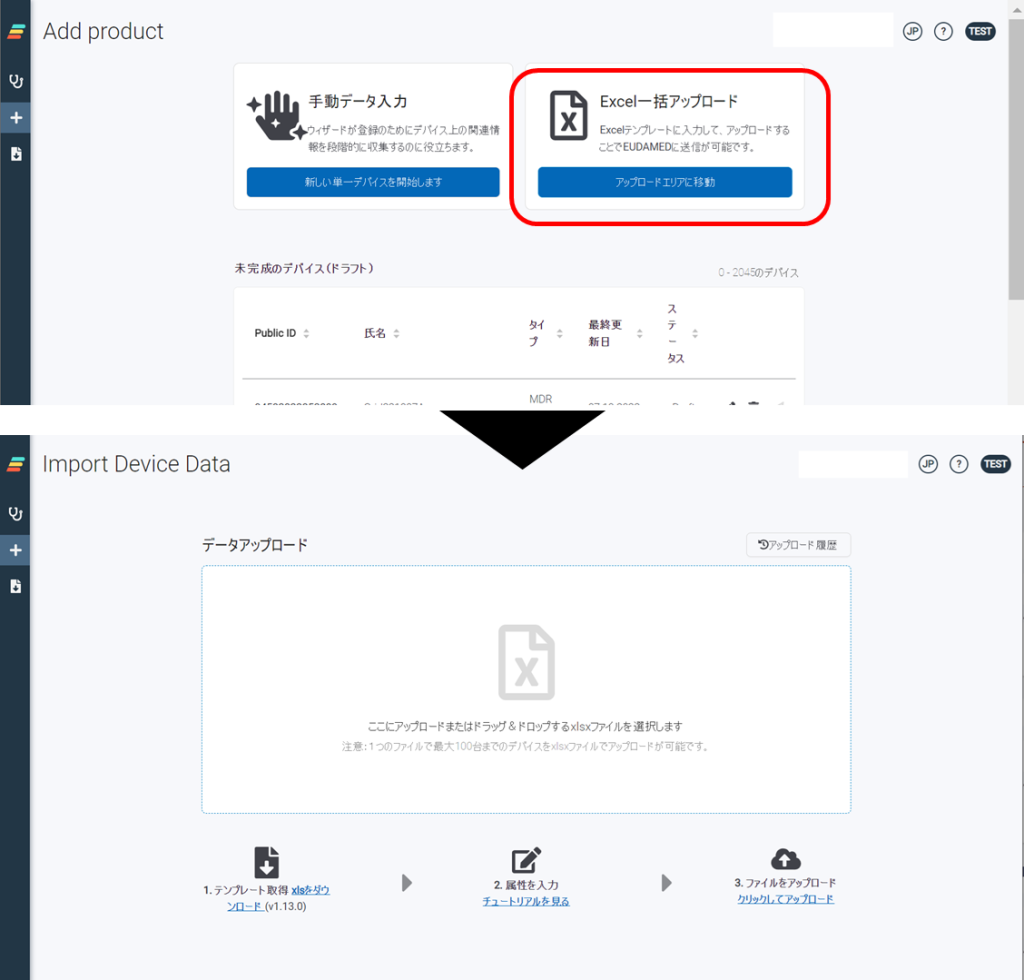
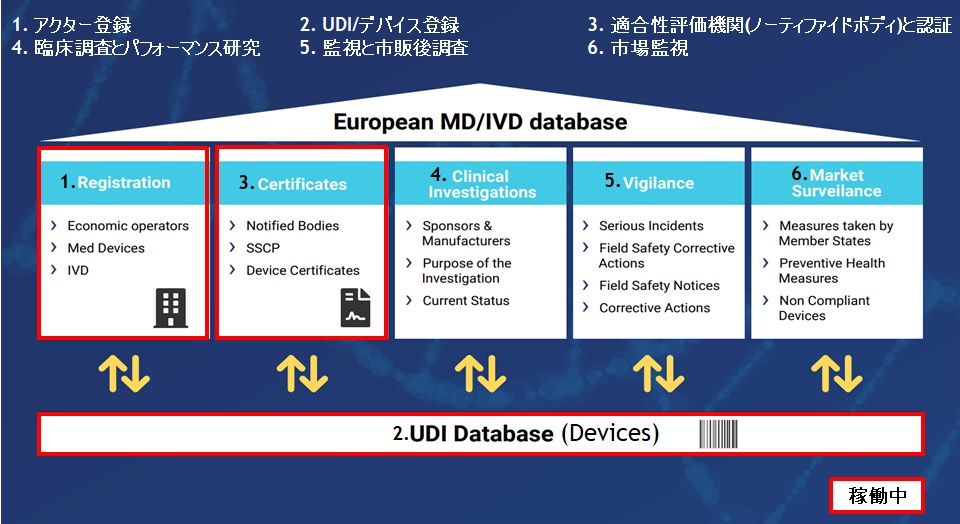
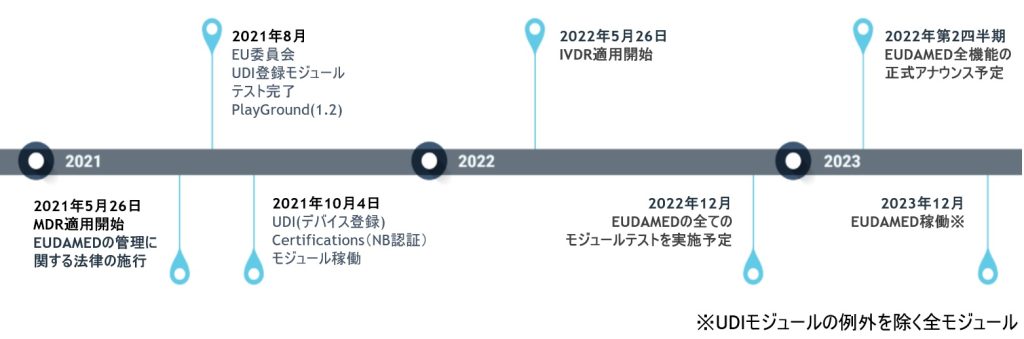
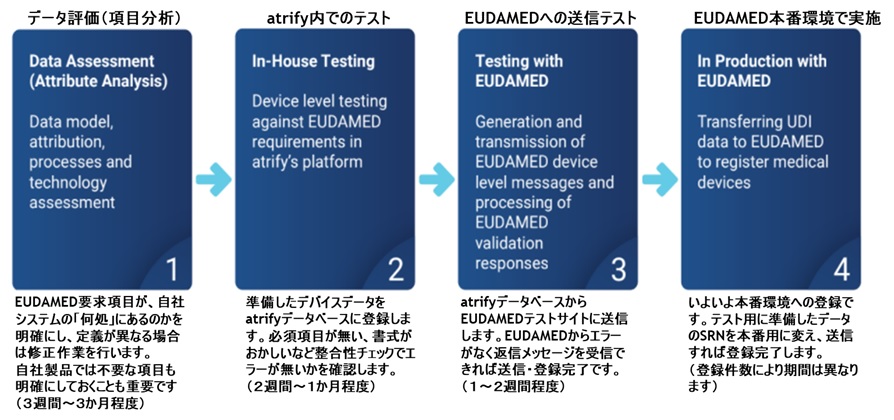
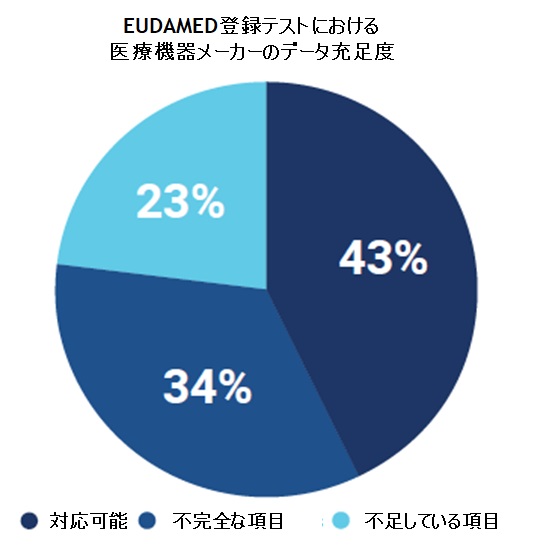
EUDAMED Data Dictionary の列項目の中に「ENUM Reference Code」というものがあります。こちらの項目は、EUDAMEDで使用できる「コード名」と「指定された値」が定義されており、正しい値をセットしないとエラーとなります。
この「ENUM Reference Code」にも定義書が存在しており、2023年1月現在、EUDAMED Productionサイト(本番環境)と同じv2.9が最新版で、PDFファイルが下記にアップされています。
EMUN Reference Codeの項目例として、
| Field ID | Field Label | 項目内容 | ENUM Reference Code | ENUM Values |
|---|---|---|---|---|
| FLD-UDID -291 | Issuing Entity UDI-DI | UDI-DIの発行元機関コード | ENUM_MDR _IssuingEntity | GS1、HIBCC、ICCBBA、IFA、 EUDAMED 発行元機関の詳細はこちら |
| FLD-UDID -148 | Type of UDI-PI | 適用可能な UDI-PI (プロダクション識別子) のタイプ | ENUM_UDID _Production Identifier | BATCH_NUMBER、 EXPIRATION_DATE、 MANUFACTURING _DATE、 SERIALISATION _NUMBER、 SOFTWARE _IDENTIFICATION |
| FLD-UDID -149 | Nomenclature code | EMDNコード | ENUM_UDID _MDN (DDv2.9内ではEMDN Nomenclatureと記載だが、 誤記載と思われます) | 6460個の中から選択 EMDNの詳細はこちら |
があります。上記の例以外では、
- サイズ単位(FLD-UDID-195:/Measure Unit、 ENUM_UDID_ClinicalSizeMeasureUnit、値数174個)
- 重大な警告タイプ(FLDーUDID-212:Critical Warnings type、 ENUM_UDID_CriticalWarnings、値数423個)
など計30個程度のENUM Reference Codeが定義されています。