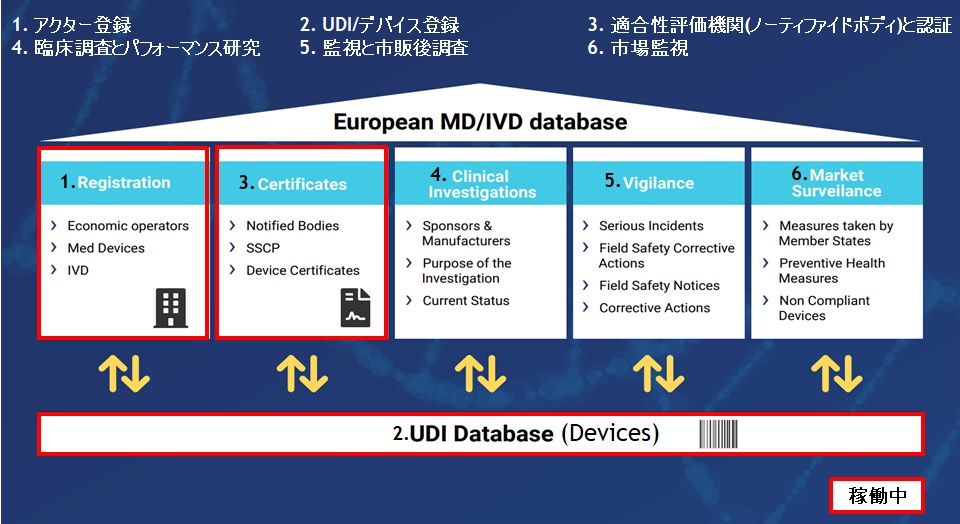
EUDAMEDとは、European Database on Medical Devicesの略称です。欧州医療機器規則(Medical Device Regulation 2017/745: MDR)の枠組みにおいて機器、UDI、適合性評価機関(ノーティファイドボディ)、認証、臨床試験、市販後調査等の情報の閲覧・登録が可能なデータベースを指します。EUDAMEDシステムは、登録システム、共同システム、通知システム、および配布システム(一般に公開)など6つの機能を有し、相互運用可能になります。2022年4月現在で3つの機能が稼働しています。
参照: https://ec.europa.eu/health/md_eudamed/overview_en
EUDAMEDには、次の6つのモジュールが含まれています。
- アクター登録 【2020年12月稼働開始】
- UDI/デバイス登録 【2021年10月稼働開始】
- 適合性評価機関(ノーティファイドボディ)と認証 【2021年10月稼働開始】
- 臨床調査とパフォーマンス研究
- 監視と市販後調査
- 市場監視