atrify社が監修・作成したEUDAMED E BOOK 「Why and how to use it already now!」は、EUDAMEDと米国FDA GUDIDとの違いや、実施に向けた課題の整理などについてまとめた電子ペーパーです。この度、日本のお客様向けに日本語版が発行されました。資料をご希望の方は、下記フォームに必要事項を入力いただくことでダウンロードできます。


atrify社が監修・作成したEUDAMED E BOOK 「Why and how to use it already now!」は、EUDAMEDと米国FDA GUDIDとの違いや、実施に向けた課題の整理などについてまとめた電子ペーパーです。この度、日本のお客様向けに日本語版が発行されました。資料をご希望の方は、下記フォームに必要事項を入力いただくことでダウンロードできます。

フィンランドは、欧州委員会(EC)が設定(予定)している期限に先立って、EUDAMEDへのUDIデータ登録の義務化を発表した最初の管轄当局となりました。これにより、フィンランド国内で活動する医療機器メーカーは、UDIデータをEUDAMEDへ登録し、当局へ提出することが義務付けられました。

フィンランドの管轄当局(fimea)が発表した資料は以下にあります(英語サイト)。
UDI/device に関する記述では、EUDAMED UDI モジュール稼働後60日以内に登録とあります。また、IVD-Legacy デバイスについても、2022年8月25日までの登録期限を設けています。レガシー製品で対象となるものは、FimeaまたはCEREに、すでに登録されたデバイスとなっています。いずれにしても、MDR/IVDRの認証を受けた製品だけでなく、過去に登録、流通している製品についてもEUDAMEDへの登録が義務化されたため、対象医療機器メーカー各社は、EUDAMED全体のスケジュール、およびECが発表する登録期限と関係無く、フィンランド向け対応が必要となることを意味しています。
atrifyでは、EUDAMEDへのUDIデータ登録をサポートするコンサルティングサービスや、WEBインターフェース、エクセルアップロードなど、EUDAMEDへUDIデータ登録をサポートする各種サービスを提供しています。グリッドエージェントは日本語による対応でatrifyとともに、貴社のUDIデータをEUDAMEDに登録するサポートを実施しています。
EUDAMEDにUDIを登録する際には、「Basic UDI-DI」というEUDAMED特有のコードがあります。「Basic UDI-DI」は、EUDAMEDデータベース内のデバイス関連情報へアクセスするためのキーコードで、他の文書(証明書(無料販売証明書を含む)、EU適合宣言、技術文書、安全性と臨床性能の要約)等を参照する際にも利用されます。一つの「Basic UDI-DI」には、複数のUDI-DI (製品ラベルに記載された製品識別子のコード)を紐づけることが可能です(MDR/IVDR時)。また「Basic UDI-DI」の番号及びバーコード(そもそも作成不要)の製品ラベル上への印字は不要です。
「Basic UDI-DI」を決定する要因としては、EUDAMEDのFAQでは以下4点が記載されています。
これは製品特性が同一の製品群は、「Basic UDI-DI」が共通であるべきということで、一般的には、製品ブランドが同じであるとか、仕様書、取扱説明書が同一であるとかといったことと考えてよいですが、注意すべき点として、MDR/IVDRのリスククラス(Risk Class)が同一という点が挙げられます。リスククラスが異なる場合は、同一ブランド群の製品であっても、「Basic UDI-DI」はそれぞれに付与しなくてはいけません。NB認証、臨床試験データについても同様です。また、パッケージ(パック、ケースなど)の階層品については、単品のUDI-DIは同一のデバイスとなるため、「Basic UDI-DI」は同一のコードを使用します。「Basic UDI-DI」に関しては、EUサイトのヘルプデスクFAQページに記載されています(英文)。
https://eu-udi.zendesk.com/hc/en-150/articles/360018649758-What-is-a-Basic-UDI-DI-
また、MedTech EUROPE が作成した「Basic UDI-DI」のガイダンス文書「MedTech Europe guidance for assigning Basic UDI-DI」に「Basic UDI-DI」を決定するためのフローチャート(Decision Tree)等が、文書5ページ以降に記載されています。
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(4) ・・・ Basic UDI-DIに関連した項目と設定値の定義について
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について
Basic UDI-DI(6) ・・・ レガシーデバイスにおけるBasic UDI-DIの値について
「Basic UDI-DI」を作成するにあたって、まず最初に、どの発行元(Issuing Entity)のコード体系を利用するかを事前に決めておく事が重要です。EUDAMEDで利用可能な発行元コードは、委員会実装決定(EU) 2019/939 に基づき、
の4つの発行元機関を利用できます。また、MDD/IVDD/AIMDD認証機器(既出荷済のレガシーデバイス)については、発行元を「EUDAMED」として登録します。どの発行元コードを使うかは、各医療機器メーカーの製品コード体系に沿ったもので問題ありません。製品群、カテゴリなどにより、異なるコード体系を利用している場合は、「Basic UDI-DI」も、それぞれ異なるコード体系を利用できます。ただし、EUDAMEDに新製品を登録する際には、MDR/IVDRで認証取得するため、その新製品の製品ラベルに記載(印字)するコード体系と同一のものを利用した方が、管理の面からはメリットが大きいと考えられます。EUサイトの詳細説明ページ(英文)はこちらから確認できます。
https://ec.europa.eu/health/medical-devices-topics-interest/unique-device-identifier-udi_en

◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(4) ・・・ Basic UDI-DIに関連した項目と設定値の定義について
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について
Basic UDI-DI(6) ・・・ レガシーデバイスにおけるBasic UDI-DIの値について
GS1コード体系を利用した「Basic UDI-DI」は世界中の多くの医療機器メーカーで採用されています。
GS1では「Basic UDI-DI」は「GMN(Global Model Number)」と定義され、GS1のホームページに詳細記述があり、こちらで確認できます(英文)。
「Basic UDI-DI」は最大25桁のコードと規定されており、その中で最後の2桁はチェックキャラクタと呼ばれる発番された番号からルールにより計算された値がセットされます。計算ルールは、GS1のサイトのこちら
https://www.gs1.org/sites/default/files/checkcharacterpaircalculation_1.pdf
で開示されているため、ルールを自社システムに組み込むことや、計算ルールを実装したアプリ等を利用することもできます。GS1では、チェックキャラクタ2桁を確認できる「GMN Generator」のページが公開されています。こちらからも正しいチェックキャラクタを確認できます。
https://www.gs1.org/services/check-character-calculator
GS1コード体系を利用した「Basic UDI-DI」では、GS1事業者コード(GS1 Company Prefix)と、自社が決めるモデル名、番号等の名称を組み合わせて作成します。GS1事業者コードは、GS1 Japan発番のものであれば「45」 または「49」から始まる7桁、9桁、10桁のコードとなります。
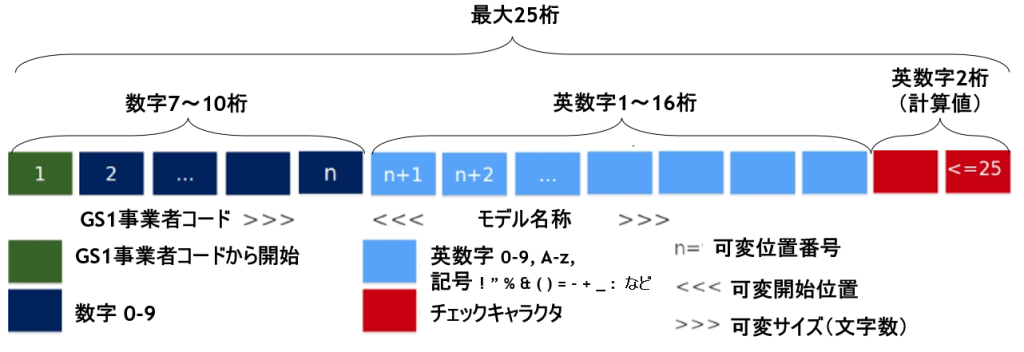
「Basic UDI-DI」の例: 491234567Brand_Name-AA3H
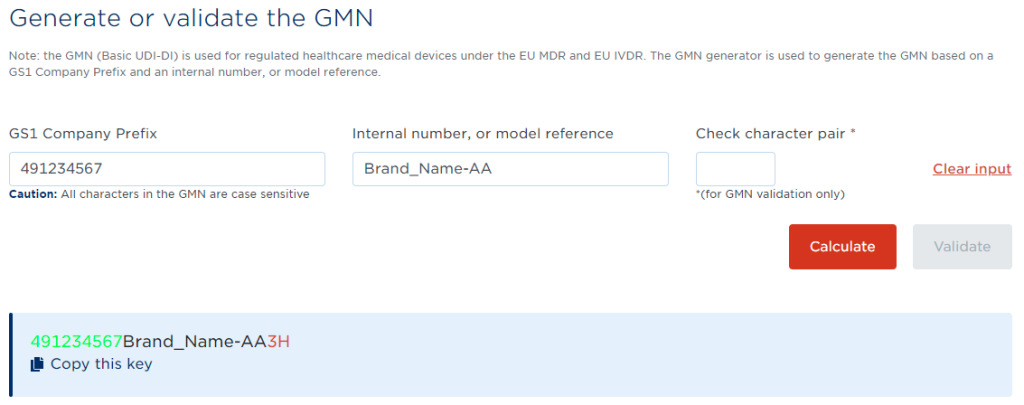
GS1 GMN Generator ページの表示例
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
Basic UDI-DI(4) ・・・ Basic UDI-DIに関連した項目と設定値の定義について
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について
Basic UDI-DI(6) ・・・ レガシーデバイスにおけるBasic UDI-DIの値について
EUDAMEDにデバイスデータ(単品UDI-DI)を登録する際には、その上位概念となる「Basic UDI-DI」を紐づけて登録することが必須のため、「Basic UDI-DI」データを先に登録しておく必要があります。
atrify UDI Managerのエクセルアップロード機能は、「Basic UDI-DI」と「UDI-DI」(単品、パッケージ階層なども)を同時に作成、アップロード、また、EUDAMEDへの送信・登録をワンステップで実行できる機能を備えています。
EUDAMEDのデータ項目には、データディクショナリ内の「Occurrence(発生)」という列で「Class Occurrence」(項目グループ単位)と「Attribute Occurrence」(FLD-UDID-XXXで定義される項目単位)で、
がそれぞれ指定されています。Class Occurrennceとなる項目グループは、「Basic UDI-DI」を例にすると、Certificate(認証)関連の項目や、Clinical Investigation(臨床試験)関連の項目などが一括りの項目グループとして取り扱われます。
| FLD番号 | 項目名 | Class Occurrence | Attribute Occurrence |
|---|---|---|---|
| FLD-UDID-14 | Basic UDI-DI Code | なし | 1 |
| FLD-UDID-15 | Authorised Representative | なし | 0..1 |
| FLD-UDID-149 | Nomenclature Code | なし | 1..n |
| FLD-UDID-147 | Annex XVI Non Medical Device Type | なし | 0..n |
| FLD-UDID-60 | Certificate Type | 0..1 | 1 |
| FLD-UDID-61 | Certificate Number | 0..1 | 0..1 |
| FLD-UDID-51 | Clinical Investigation Reference | 0..n | 1 |
| FLD-UDID-300 | Non EU Applicable Countries | 0..n | 0..n |
FLD-UDID-60、FLD-UDID-61は、Certificateグループ項目に属しています。このグループは、Class Occurrenceが「0..1」のため任意グループ項目となりますが、Certificate関連情報を登録する際(MDRではClass IIb または III、IVDRではClass B、C、D。それぞれに別途、条件があります。 )には、FLD-UDID-60は必須、FLD-UDID-61は任意で繰返し不可=一つだけ設定可という定義になります。
なお、MDR製品の「Basic UDI-DI」項目は大きく分けて4つのセグメントから構成されています。
IVDR、システム/プロシジャーパックでは、設定するデータ項目が若干異なるため注意が必要となります。これらの4つのセグメントのデータ項目の条件を満たせれば、「Basic UDI-DI」データの登録は完了します。EUDAMED本番(Production)環境へのデータ登録は、事前にテストサイト(EUDAMED PlayGround)環境で十分なテストを実施した上で登録することを推奨しております。
EUサイトにUDIデータの登録ステップの流れを説明した資料があります。
https://ec.europa.eu/health/system/files/2021-11/md_eudamed-udi-registration-process_en_0.pdf
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について
Basic UDI-DI(6) ・・・ レガシーデバイスにおけるBasic UDI-DIの値について
Certificate(認証)関連データ項目の登録有無については、MDRではClass IIb、Class III 製品が、IVDRでは、Class B、Class C、Class D 製品が対象となります。
EU型式審査証明書(EU Type-Examination Certificate)、EU技術文書審査証明書(EU Technical Documentation Assessment Certificate)の必須の有無は、「Basic UDI-DI」のModel Data(製品の特性に関する情報)関連項目(MDRでは、Implantable(FLD-UDID-30)と、Sutere/Staples(FLD-UDID-265))の設定値とリスククラスで、以下のように定義されています。
| MDR リスククラス Risk Class | デバイスタイプ Device Type | FLD番号 | 設定値 | EU型式審査 証明書 EU Type Examination Certificate (Annex X) | EU技術文書 審査証明書 EU Technical Documentation Assessment Certificate (Annex IX Chapter II) |
|---|---|---|---|---|---|
| IIb | Implantable = N | FLD-UDID-30 | False | 必須 | |
| IIb | Implantable = Y Suture/Staples = Y | FLD-UDID-30 FLD-UDID-265 | True True | 必須 | |
| IIb | Implantable = Y Suture/Staples = N | FLD-UDID-30 FLD-UDID-265 | True False | TE または TDの どちらかが必須 | TE または TDの どちらかが必須 |
| III | すべて | FLD-UDID-30 FLD-UDID-265 | True/False True/False | TE または TDの どちらかが必須 | TE または TDの どちらかが必須 |
IVDRでは、Near Patient Testing (FLD-UDID-35)と、Self-Patient Testing(FLD-UDID-36)の設定値とリスククラスにより、以下のように定義されています。
| IVDR リスククラス Risk Class | デバイスタイプ Device Type | FLD番号 | 設定値 | EU型式審査 証明書 EU Type Examination Certificate (Annex X) | EU技術文書 審査証明書 EU Technical Documentation Assessment Certificate (Annex IX Chapter II) |
|---|---|---|---|---|---|
| B | Near Patient Testing Self-Patient Testing のどちらかがY | FLD-UDID-35 FLD-UDID-36 | どちらかが Ture | 必須 | |
| C | Near Patient Testing=N Self-Patient Testing=N | FLD-UDID-35 FLD-UDID-36 | False False | 必須 | |
| C | Near Patient Testing Self-Patient Testing のどちらかがY | FLD-UDID-35 FLD-UDID-36 | どちらかが Ture | TE または TDの どちらかが必須 | TE または TDの どちらかが必須 |
| D | すべて | FLD-UDID-35 FLD-UDID-36 | True/False True/False | TE または TDの どちらかが必須 | TE または TDの どちらかが必須 |
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(4) ・・・ Basic UDI-DIに関連した項目と設定値の定義について
Basic UDI-DI(6) ・・・ レガシーデバイスにおけるBasic UDI-DIの値について
従来のCEマークを取得済みの医療機器は、EUDAMEDではLegacy Device(レガシーデバイス)と定義され、
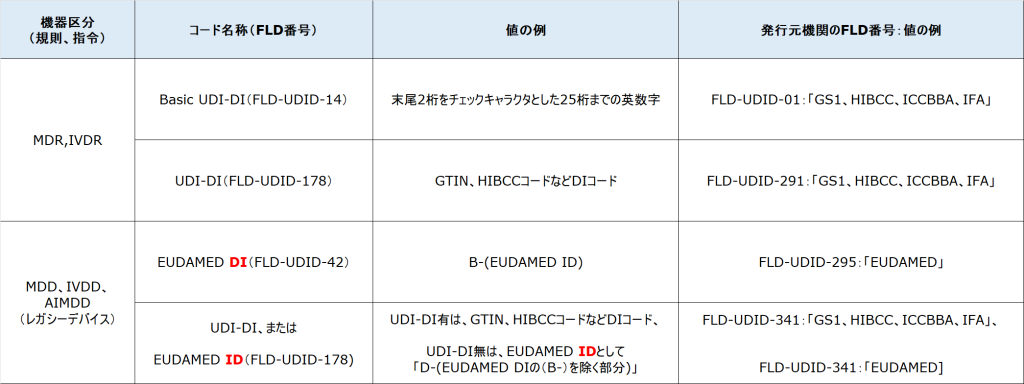
に該当するデバイスを指します。2021年5月のMDR、2022年5月のIVDRが開始された以降も市場で流通するレガシーデバイスについてはEUDAMEDへの登録が求められています。EUDAMEDにレガシーデバイスを登録する際には、「Basic UDI-DI(FLD-UDID-14)」コードに相当する部分は、「EUDAMED DI(FLD-UDID-42)」コードとなり、項目番号、名称とも異なるコードを使用します。
また、MDR/IVDR製品では、「Basic UDI-DI(FLD-UDID-14)」には、登録側の医療機器メーカーが、発行元機関「Issuing Entiry(FLD-UDID-01)」をGS1、HIBCCなどに決定し、各機関のルールに沿って独自で採番しますが、レガシーデバイスの「EUDAMED DI(FLD-UDID-42)」は、コード発行元機関「Issuing Entity for EUDAMED DI(FLD-UDID-295)」を「EUDAMED」とし、「EUDAMED DI(FLD-UDID-42)」には、「B-(UDI-DIコード)」の形で登録する仕様となっています。UDI-DIを持っていない機器については、まず、EUDAMED DIを「B-(21桁までの「SRN番号+製品コード」+チェックキャラクタ2桁)」で作成し、頭の「B-」を「D-」に置き換えることで「EUDAMED ID(FLD-UDID-342)」としてコードを作成します。その場合はFLD-UDID-341のコード発行元機関を「EUDAMED」とします。
今後、GTIN、HIBCCコード等のUDI-DIが存在しないレガシー製品が、どの程度市場で流通し続けるものなのか不明ですが、そのような製品であってもEUDAMEDには登録できるようになっています。レガシーデバイスのコード設定についての詳細は、ECのサイトに「Management of Legacy Devices MDR EUDAMED Date: 15 .02.2021 Doc. Version: 1.2」文書があります。
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(4) ・・・ Basic UDI-DIに関連した項目と設定値の定義について
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について
Basic UDI-DI が無事登録できた場合は、各デバイスデータの登録に進むことができるようになります。UDI-DIのデータ項目は大きく分類すると、以下の7つから構成されています。
UDI-DIのデータは、全部で70個以上の項目について登録を求められています。
その中で、登録後の更新が「可能」・「不可」と定義されている項目が混在しているため、登録の際には注意が必要です。
また更新可能な項目の場合でも、空白(NULL値=No Value)で登録された場合のみしか更新(変更追加)できない項目も多数あります。
◆UDI-DI 関連投稿はこちらからどうぞ◆
UDI-DI(2) ・・・ マーケット(市場)情報について
UDI-DI(3) ・・・ EMDNコードについて
UDI-DI(4) ・・・ パッケージ情報について
UDI-DI(5) ・・・ 使用単位のDIコード
MDR/IVDR/レガシーに関わらず、下記のEU加盟国(準加盟等含む)市場で流通する(将来流通される予定も含む)デバイスは、EUDAMEDへの登録対象となります。マーケット情報を入力するには、FLD-UDID-130(Device Status Code)を、「ON_THE_MARKET」として登録します。その場合は、FLD-UDID-137 (Member State of the placing on the EU market of the device)が必須となるため、EU内最初の出荷国(または輸出国)を設定します。「Member State of the placing on the EU market」についての厳密な定義はありませんが、市場流通させていると考えるべきなので、仮に製品を販売していない物流拠点の国が出荷先国の場合は、その先にある、最初の販売国(市場で流通している国)を登録するべきです。また、初回出荷(最初の輸出)が並行して同時期に複数国に出荷された場合は、その中の1国を代表国として記載し、他国は、併売国としてマーケット情報欄に登録します。
マーケット情報設定は、FLD-UDID-137(国名[国コード]:必須)、FLD-UDID-250(開始日:任意)、FLD-UDID-251(終了日:任意)を設定します。流通している国が複数ある場合は、Class Occurrence(項目グループの発生定義)が0..n(任意で繰り返し可) と定義されているマーケット情報関連グループ(FLD-UDID-252(国名[国コード]:必須)、FLD-UDID-250(開始日:任意)、FLD-UDID-251(終了日:任意)を利用することで、複数国の設定が可能となります。
FLD-UDID-137/252(国名[国コード])は、2022年6月現在で、下記の国から選択できます。下記リストに存在しない欧州域内の国・地域(イギリス(北アイルランド以外)、スイス、アルバニア、ウクライナ、セルビア、ボスニア・ヘルツェゴヴィナ、モルドバ、モンテネグロ、北マケドニアなど)に出荷している場合は登録できません(現時点で必要ありませんが、今後、それらの国々がEUに加盟(準加盟)した際は追加となる場合があります)。
| 英語国名(ABC順) | 国コード | 日本語国名 |
|---|---|---|
| Austria | [AT] | オーストリア |
| Belgium | [BE] | ベルギー |
| Bulgaria | [BG] | ブルガリア |
| Croatia | [HR] | クロアチア |
| Cyprus | [CY] | キプロス |
| Czech Republic | [CZ] | チェコ |
| Denmark | [DK] | デンマーク |
| Estonia | [EE] | エストニア |
| Finland | [FI] | フィンランド |
| France | [FR] | フランス |
| Germany | [DE] | ドイツ |
| Greece | [GR] | ギリシャ |
| Hungary | [HU] | ハンガリー |
| Ireland | [IE] | アイルランド |
| Iceland | [IS] | アイスランド |
| Italy | [IT] | イタリア |
| Latvia | [LV] | ラトビア |
| Liechtenstein | [LI] | リヒテンシュタイン |
| Lithuania | [LT] | リトアニア |
| Luxembourg | [LU] | ルクセンブルク |
| Malta | [MT] | マルタ |
| Netherlands | [NL] | オランダ |
| Norway | [NO] | ノルウェー |
| Poland | [PL] | ポーランド |
| Portugal | [PT] | ポルトガル |
| Romania | [RO] | ルーマニア |
| Slovakia | [SK] | スロバキア |
| Slovenia | [SI] | スロベニア |
| Spain | [ES] | スペイン |
| Sweden | [SE] | スウェーデン |
| Turkey | [TR] | トルコ |
| United Kingdom (Northern Ireland only) | [XI] | イギリス (北アイルランドのみ) |
◆UDI-DI 関連投稿はこちらからどうぞ◆
UDI-DI(1) ・・・ UDI-DI で登録する項目概要
UDI-DI(3) ・・・ EMDNコードについて
UDI-DI(4) ・・・ パッケージ情報について
UDI-DI(5) ・・・ 使用単位のDIコード