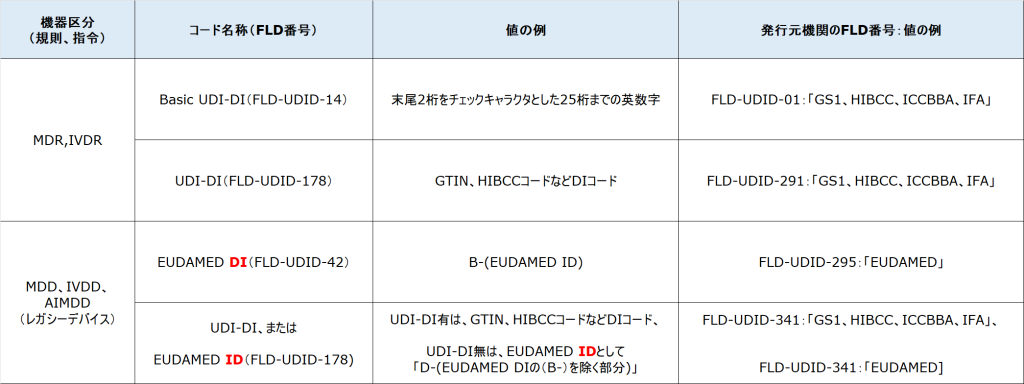
従来のCEマークを取得済みの医療機器は、EUDAMEDではLegacy Device(レガシーデバイス)と定義され、
- AIMDD(Active Implantable Medical Devices Directive(能動植込医療機器指令): 90/385/EEC)
- MDD(Medical Devices Directive(医療機器指令): 93/42/EEC)
- IVDD(In-Vitro Diagnostic Medical Devices(体外診断薬指令): 98/79/EC)
に該当するデバイスを指します。2021年5月のMDR、2022年5月のIVDRが開始された以降も市場で流通するレガシーデバイスについてはEUDAMEDへの登録が求められています。EUDAMEDにレガシーデバイスを登録する際には、「Basic UDI-DI(FLD-UDID-14)」コードに相当する部分は、「EUDAMED DI(FLD-UDID-42)」コードとなり、項目番号、名称とも異なるコードを使用します。
また、MDR/IVDR製品では、「Basic UDI-DI(FLD-UDID-14)」には、登録側の医療機器メーカーが、発行元機関「Issuing Entiry(FLD-UDID-01)」をGS1、HIBCCなどに決定し、各機関のルールに沿って独自で採番しますが、レガシーデバイスの「EUDAMED DI(FLD-UDID-42)」は、コード発行元機関「Issuing Entity for EUDAMED DI(FLD-UDID-295)」を「EUDAMED」とし、「EUDAMED DI(FLD-UDID-42)」には、「B-(UDI-DIコード)」の形で登録する仕様となっています。UDI-DIを持っていない機器については、まず、EUDAMED DIを「B-(21桁までの「SRN番号+製品コード」+チェックキャラクタ2桁)」で作成し、頭の「B-」を「D-」に置き換えることで「EUDAMED ID(FLD-UDID-342)」としてコードを作成します。その場合はFLD-UDID-341のコード発行元機関を「EUDAMED」とします。
今後、GTIN、HIBCCコード等のUDI-DIが存在しないレガシー製品が、どの程度市場で流通し続けるものなのか不明ですが、そのような製品であってもEUDAMEDには登録できるようになっています。レガシーデバイスのコード設定についての詳細は、ECのサイトに「Management of Legacy Devices MDR EUDAMED Date: 15 .02.2021 Doc. Version: 1.2」文書があります。
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(4) ・・・ Basic UDI-DIに関連した項目と設定値の定義について
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について

