2023年1月に欧州委員会によって採択された、医療機器のMDR認証への準拠期限を延長する提案について、2023年2月16日の欧州議会で可決され、認証期限の延長が正式に決定しました。
2023年1月6日に発表されたプレスリリース(英語)はこちらから確認できます。
同1月6日付の提案文書はこちらのから確認できます。
同1月19日に締切られた公式サイトには、多くのフィードバックコメントが掲載されています。詳細はこちらから確認できます。
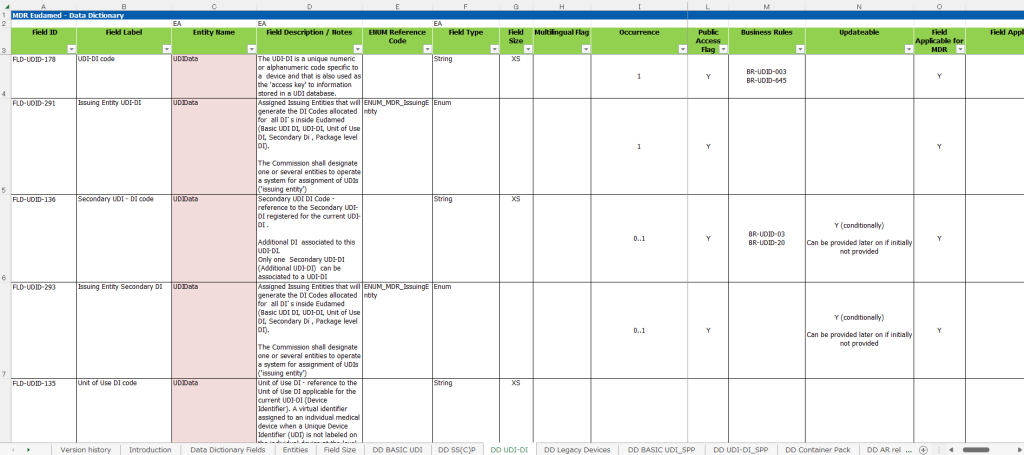
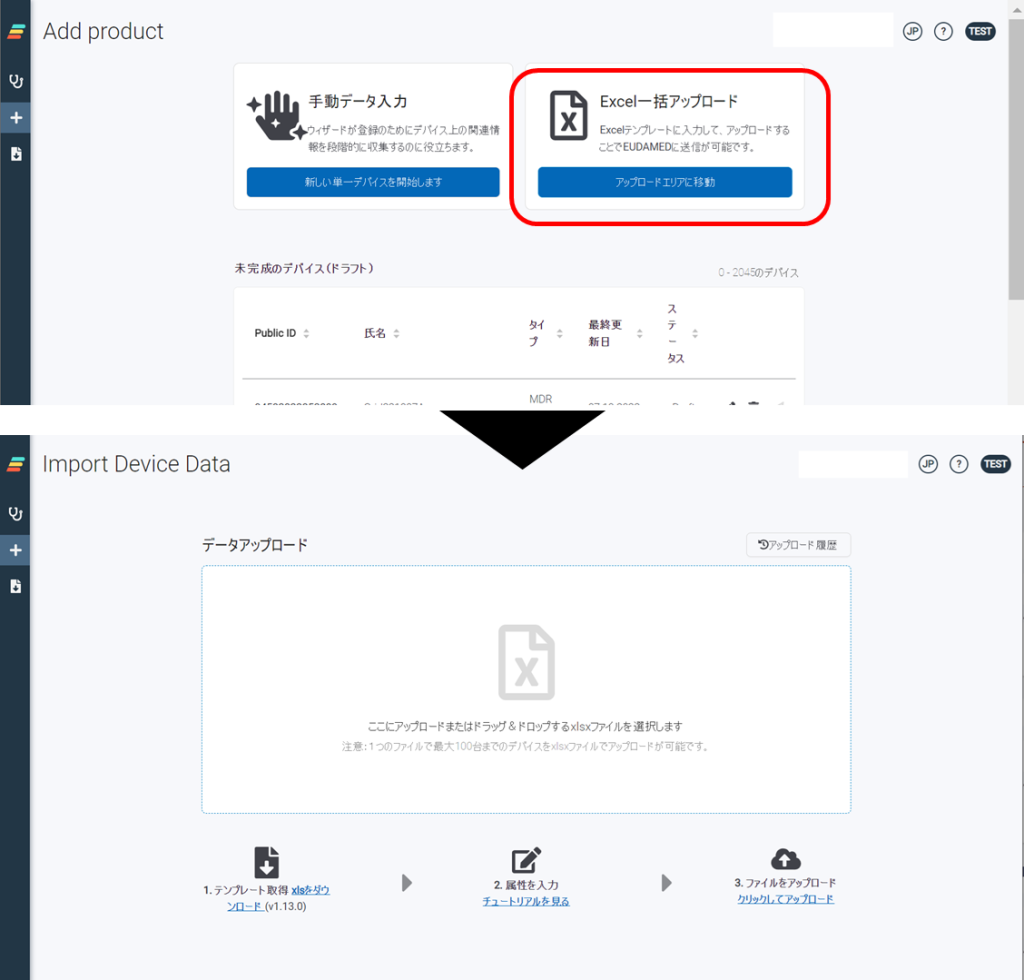
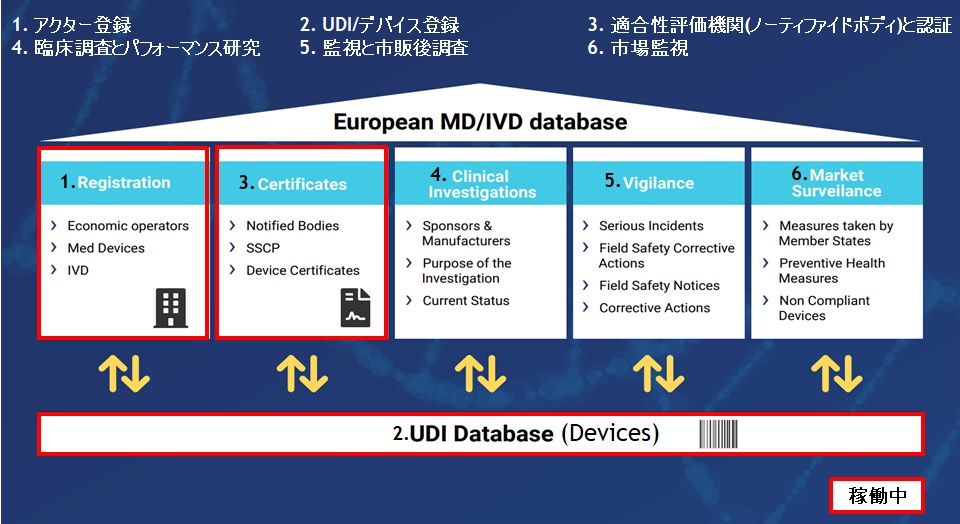
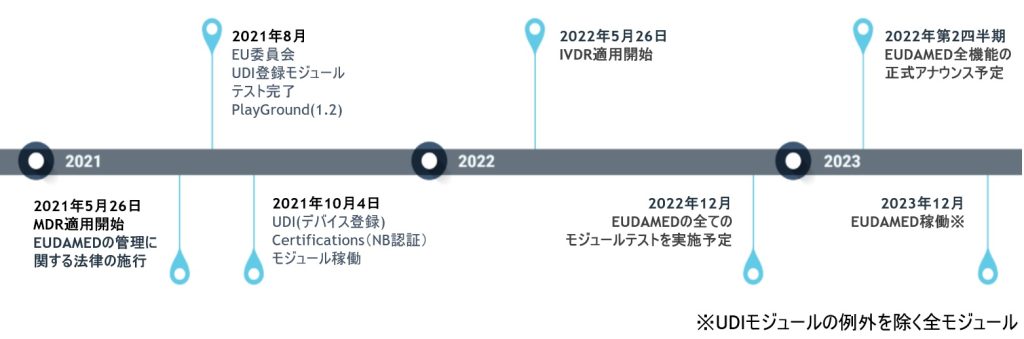
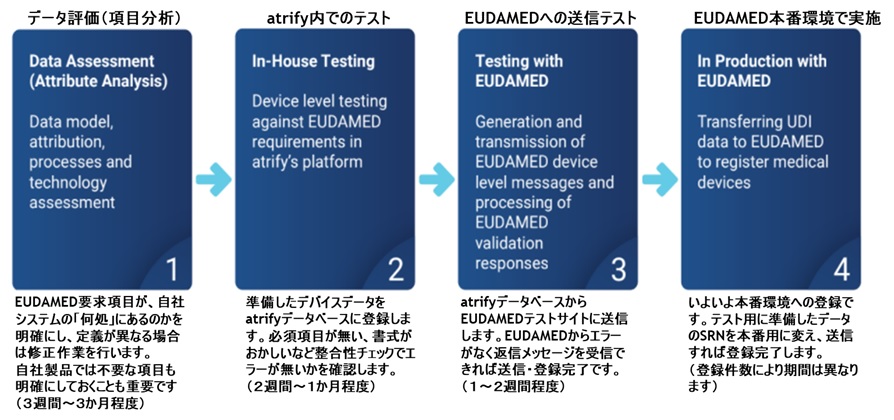
ノーティファイボディ(NB)に、MDRへの変更手続きを実施しているMDD/AIMDDのレガシーデバイス製品は、EU官報に公開された日以降、2028年(Class I(一部), IIa, IIb(インプラント以外))、または2027年(Class IIb(インプラント), III)の12月31日までレガシーデバイスとして認証期間が延長されます。延長された製品は、全てEUDAMEDへのUDI登録対象となりますので、該当製品がある医療機器メーカー様は、早めの登録準備をお薦めします。
◆レガシーデバイス認証有効期間延長に関する投稿はこちらからどうぞ◆
レガシーデバイスの認証有効期間延長・・・ 期限延長の背景、議会への提案事項