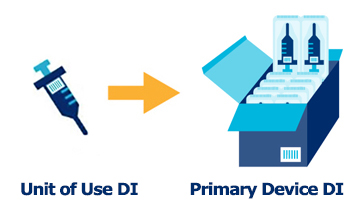
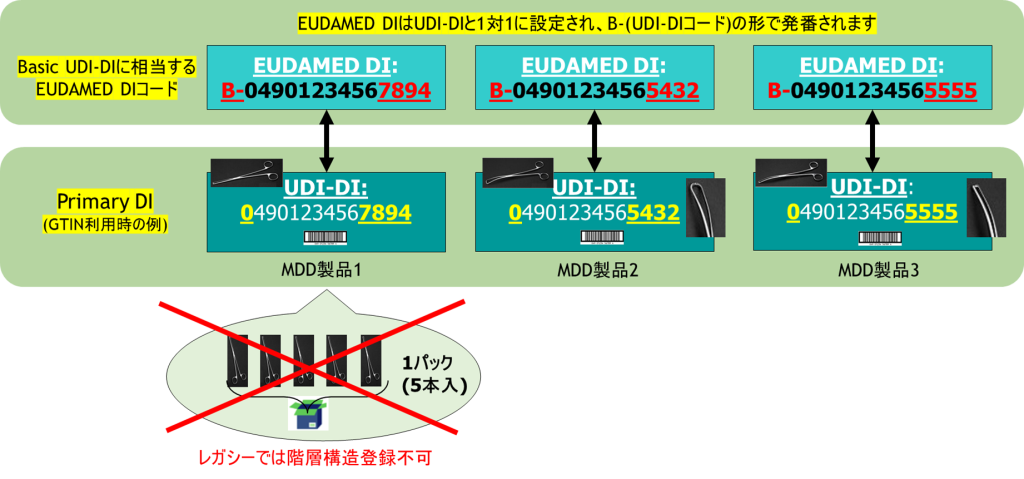
MDR/IVDR認証を受けたデバイスは、Primary DI(シングル・ユニット)としてEUDAMEDに登録します。一方で、流通形態(販売、物流など)は、シングル・ユニット単位のものもあれば、パック/ケース/パレット/コンテナなどシングル・ユニットのデバイスを複数でパッキングして取り扱うことも多いと思います。梱包品についてはGTIN等の製品識別コードを付ける/付けないの判断は、製造事業者側に委ねられていますが、現在では、多くの事業者が、流通形態の製品にも製品識別コードを付けていると思います。EUDAMEDでは、それらの流通形態の製品を階層品としてUDI-DI(多くの場合がGTIN)を紐づけて登録できます。階層構造の登録は、EUDAMED上は任意です。
GS1 ヘルスケア GTIN 設定ルール は、GS1ジャパンの日本語資料がございます。詳細はそちらでご確認いただけます。
EUDAMEDのパッケージ情報を登録する上での注意事項としては、
- パッケージ階層を登録できるのはMDR/IVDR 品のみで、レガシー(MDD/IVDD/AIMDD)品では登録できません。
- デバイスのPrimary DI(シングル・ユニット)が同一であることから、「Basic UDI-DI(FLD-UDID-145)」は同一のものとして登録します。
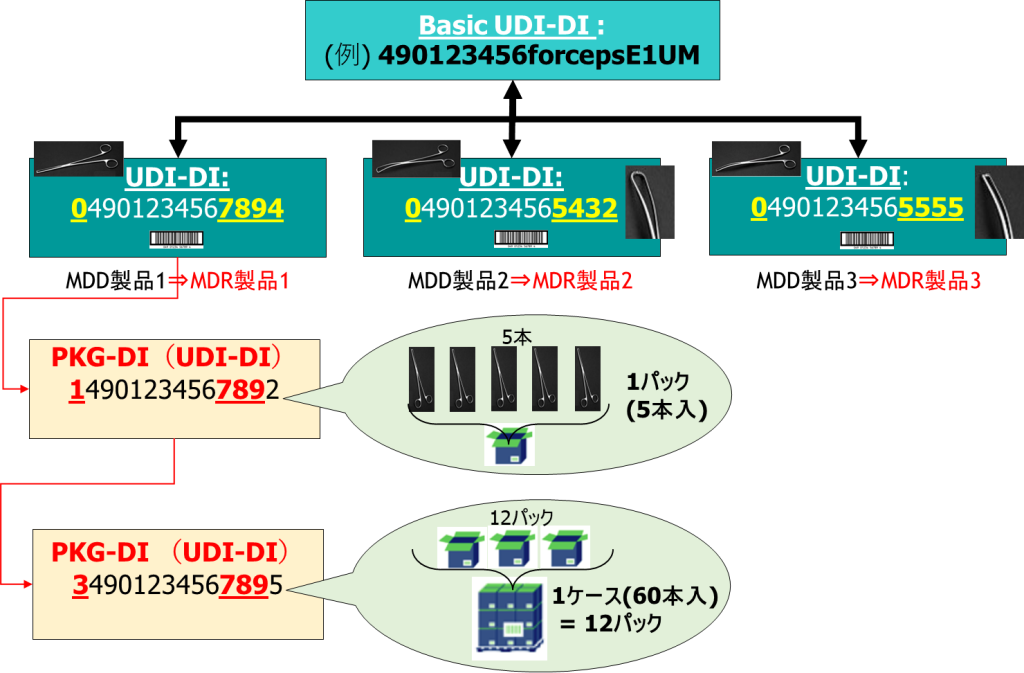
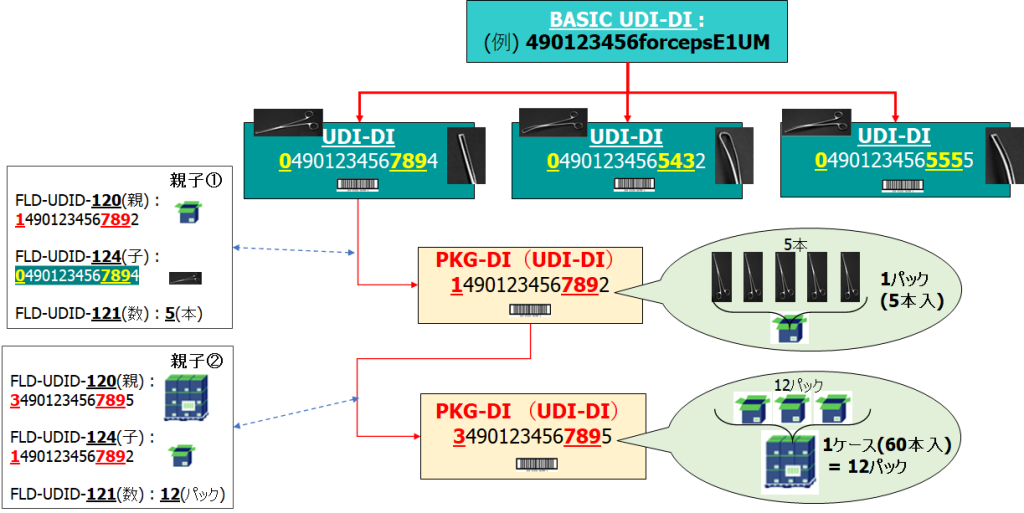
- 3階層以上(シングル・ユニット>パック(2階層目)>ケース(3階層目)>パレット(4階層目)・・・)の場合もそれぞれを親子として繰り返しで登録します。
- 「Package UDI-DI(FLD-UDID-120)」には、親階層のUDI-DIを指定し、「Related Package(FLD-UDID-124)」に子階層のUDI-DIを指定します。シングル・ユニットとケースの2階層構造品の場合は、FLD-UDID-120にケースのUDI-DI、FLD-UDID-124にシングル・ユニットのUDI-DIを指定し、入数「Quantity of Item(s) (FLD-UDID-121)」には、FLD-UDID-124のUDI-DIの入数を指定します。
- 階層構造のリンク情報は、UDI-DIを登録する時、または、後から階層構造のみを別途登録できます。(階層製品をUDI-DIとして登録する必要はありません)
◆UDI-DI 関連投稿はこちらからどうぞ◆
UDI-DI(1) ・・・ UDI-DI で登録する項目概要
UDI-DI(2) ・・・ マーケット(市場)情報について
UDI-DI(3) ・・・ EMDNコードについて
UDI-DI(5) ・・・ 使用単位のDIコード