(2)では、レガシーデバイスとして登録した製品が、MDR/IVDRの認証を受けた時の登録方法です。
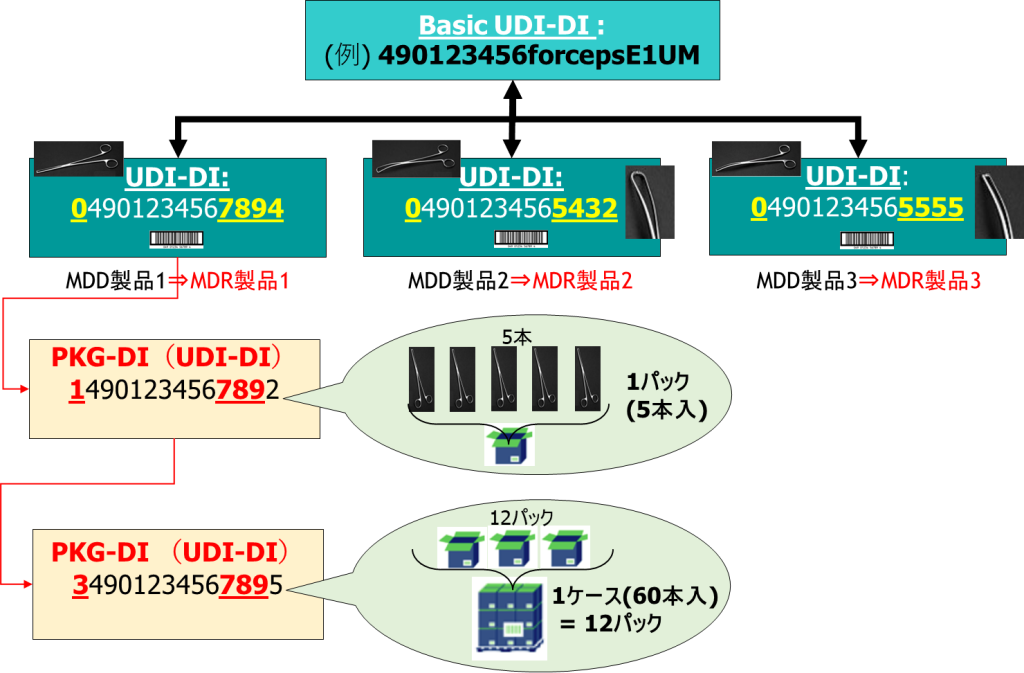
- MDR製品は、Primary DIの上位概念として「Basic UDI-DI」を登録します。「Basic UDI-DI」には、Certification(認証関連)、Clinical Investigation(臨床試験)に関する情報が必要となりますので、これらの情報を登録します。「Basic UDI-DI(4)・・Basic UDI-DIに関連した項目と設定値の定義について」を併せてご確認ください。
- すでにMDD製品としてPrimary DI(「UDI-DI」)が登録されていますが、同様の内容をMDR/IVDR製品として再度入力し、1.の「Basic UDI-DI」と紐づけます。atrify UDI Solutionのエクセルアップロード機能では、レガシー品で登録した際のデータ項目をコピー&ペースト(一部の項目は、書換が必要)で設定できるため、作業時間が大幅に削減できます。
- 「Basic UDI-DI」は、仕様、用途などが同一の複数デバイス(Primary DI、 Package DI)については、ひとつの「Basic UDI-DI」に紐づけます。
- パック/ケース/コンテナ等の物流、販売形態と製品を階層構造で定義します(階層定義は任意です)
以上の4段階の登録を実施することで、MDR製品(IVDR製品も同等)は、以下のようなイメージで登録され、レガシー製品から自動的に引き継がれます。
またMDR/IVDRとして登録できた後は、レガシー製品として登録されている製品の一部を修正することをお薦めします。レガシー側製品は、切替わった時点で出荷停止となるはずのため、レガシー側のUDI-DIにある
- 「Device Status(FLD-UDID-130)」は、「NO_LONGER_PLACED_ON_THE_MARKET」に
- さらに、Market Info欄の出荷対象国の「End Date(FLD-UDID-251)」にも販売終了日
をそれぞれ個別に変更する必要があります。これらの2項目については、MDDからMDRに変更しても自動的に修正される仕様ではありませんのでご注意ください。
◆レガシーデバイス登録の関連投稿はこちらからどうぞ◆
レガシーデバイスの登録(1) ・・・ 登録ルール

