レガシーデバイス(MDD/AIMDD/IVDD製品)は、2024年5月26日までが有効期限となっている(IVDD製品はそれ以降も可のケースもあります)ため、それ以降もEU市場にて引き続き販売(流通)する製品については、有効期限内にMDR/IVDR認証取得が必要となります。MDR/IVDR認証を受ける際に、UDI-DI(例:GTIN)を継続して使用する場合も多いと思われます。そうした場合には、EUDAMEDへどのようにUDI登録するべきでしょうか?
EUDAMEDへのUDI登録の中で、レガシーデバイスについては以下ルールが設けられています。
- レガシーデバイスは、Primary DI(認証を受けている単品)のみ登録します(製品階層の定義はできません)
- レガシーデバイスとして登録する際には、「Basic UDI-DI(FLD-UDID-14)」に代わる「EUDAMED DI(FLD-UDID-42)」が必要となり、Primary DIと1対1に紐づけたIDを登録します(MDR製品の「Basic UDI-DI」は複数の「UDI-DI」を紐づけることができますが、「EUDAMED DI」は複数の「UDI-DI」を紐づけできません。あくまで1対1の組み合わせのみ有効です)
- 「UDI-DI」に相当するコードがない製品の場合は、「EUDAMED ID」としてPrimary DIを定義し登録します。
「Basic UDI-DI(6)・・レガシーデバイスにおけるBasic UDI-DI」 も併せてご確認ください。
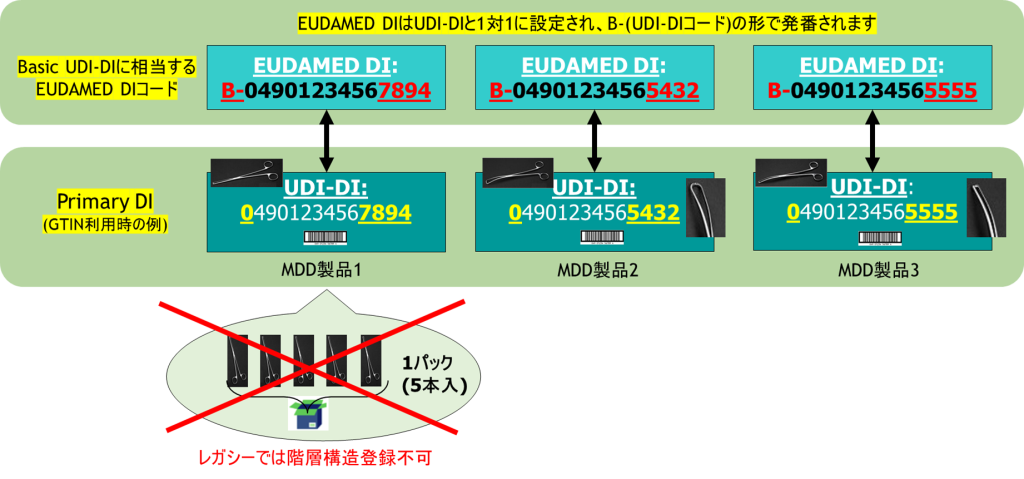
レガシーデバイスをお持ちの場合は、まずは上記のような方法でEUDAMEDへUDI登録を完了していただくことをお薦めします。登録は、欧州委員会のポータルサイトからも、atrify UDI Solution等の3rdパーティー・ソリューションを利用するなどの方法でも登録できます。また、Primary DIとして登録されたデバイスの内容は、今後、MDR/IVDRの認証を受けた際に、そのままデータ内容を引き継いでMDR/IVDR製品として登録できるようになっています。
◆レガシーデバイス登録の関連投稿はこちらからどうぞ◆
レガシーデバイスの登録(2) ・・・ MDR/IVDR引継登録

