EUDAMEDでは、Nomenclature Code(FLD-UDID-149)が必須項目として指定されています。この項目には、EMDN(European Medical Device Nomenclature、欧州医療機器名称)コードを入力します。EMDNコードには、CATEGORY(E、I、O、X除くAからZ)、LEVEL(1-7)に対して、1対1でコードが割り振られています。
| CATE GORY | CATEGORY DESCRIPTION | LEVEL | EMDN CODE | EMDN CODE DESCRIPTION |
|---|---|---|---|---|
| G | GASTROINTESTINAL DEVICES | 6 | G0301010102 | OESOPHAGEAL BALLOON CATHETERS, HIGH PRESSURE |
| H | SUTURE DEVICES | 7 | H010202020401 | TITANIUM MULTIFILAMENT WITH NEEDLE |
| K | ENDOTHERAPY AND ELECTROSURGICAL DEVICES | 4 | K010301 | SPINAL PERCUTANEOUS PLASTIC DEVICES WITH BALLOON |
EUDAMEDで登録するEMDNコードは、LEVELが最下層になっているもののみ登録できます。上記のEMDNコード「G0301010102:OESOPHAGEAL BALLOON CATHETERS, HIGH PRESSURE」を例とすると、その階層構造は、
| CATE GORY | CATEGORY DESCRIPTION | LEVEL | EMDN CODE | EMDN CODE DESCRIPTION |
|---|---|---|---|---|
| G | GASTROINTESTINAL DEVICES | 1 | G | GASTROINTESTINAL DEVICES |
| G | GASTROINTESTINAL DEVICES | 2 | G03 | GASTROINTESTINAL ENDOSCOPY DEVICES |
| G | GASTROINTESTINAL DEVICES | 3 | G0301 | DEVICES FOR DILATION IN DIGESTIVE ENDOSCOPY |
| G | GASTROINTESTINAL DEVICES | 4 | G030101 | GASTROINTESTINAL ENDOSCOPY, BALLOON CATHETERS |
| G | GASTROINTESTINAL DEVICES | 5 | G03010101 | OESOPHAGEAL BALLOON CATHETERS |
| G | GASTROINTESTINAL DEVICES | 6 | G0301010102 | OESOPHAGEAL BALLOON CATHETERS, HIGH PRESSURE |
のように定義されています。
EUDAMEDへは最下層として定義されているLEVEL6:OESOPHAGEAL BALLOON CATHETERS, HIGH PRESSURE を登録します。上位階層での登録はできません。登録に際し、自社製品のEMDNコードが何であるのかを、改めて整理、確認されておくことをお薦めします。
◆UDI-DI 関連投稿はこちらからどうぞ◆
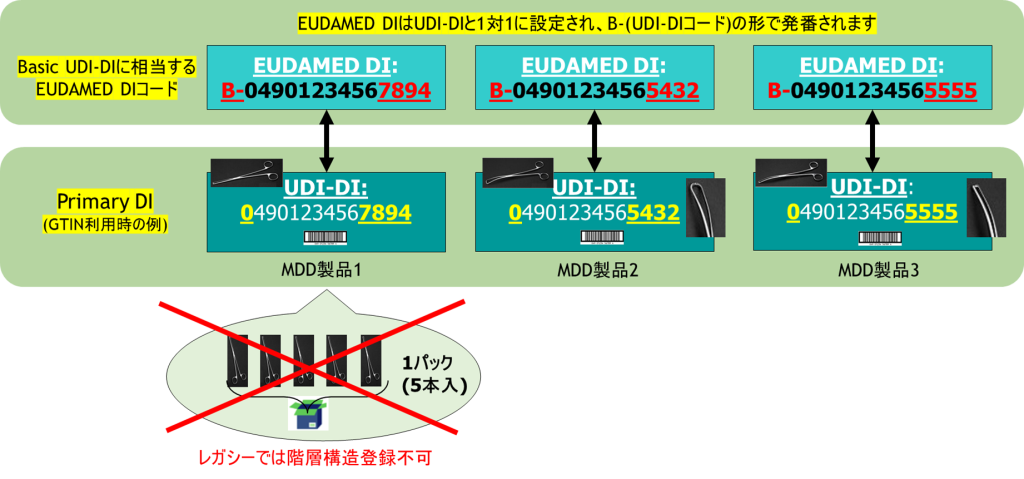
UDI-DI(1) ・・・ UDI-DI で登録する項目概要
UDI-DI(2) ・・・ マーケット情報
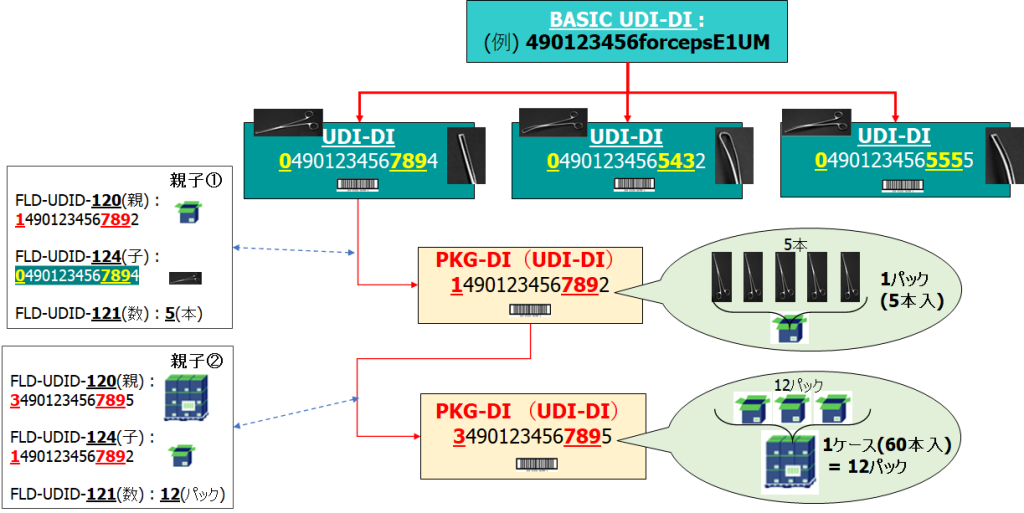
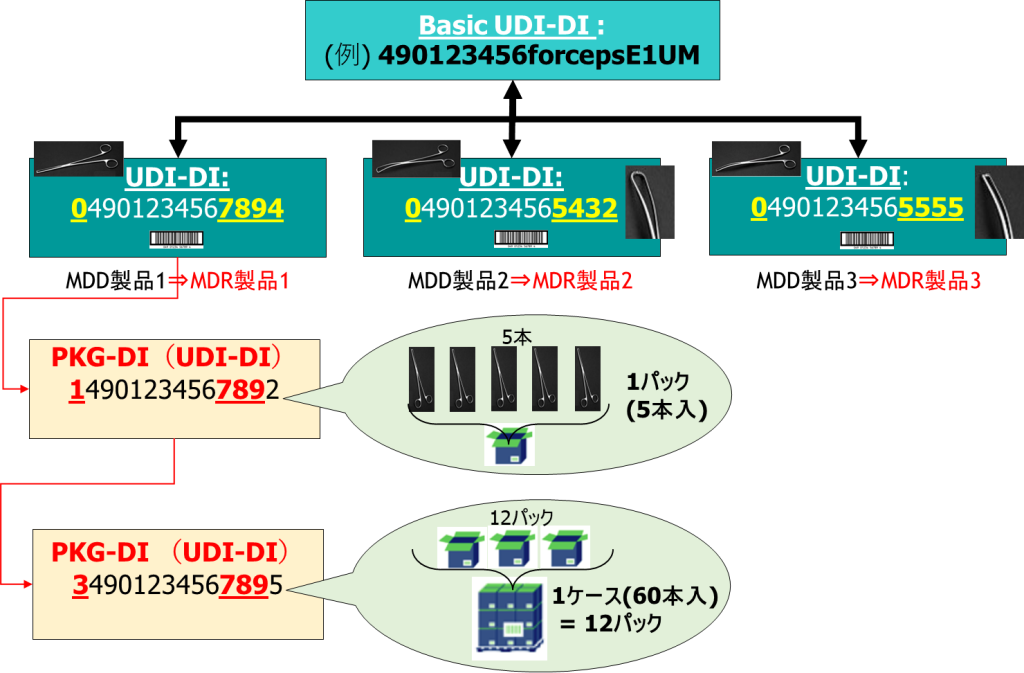
UDI-DI(4) ・・・ パッケージ情報について
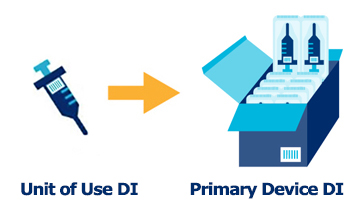
UDI-DI(5) ・・・ 使用単位のDIコード