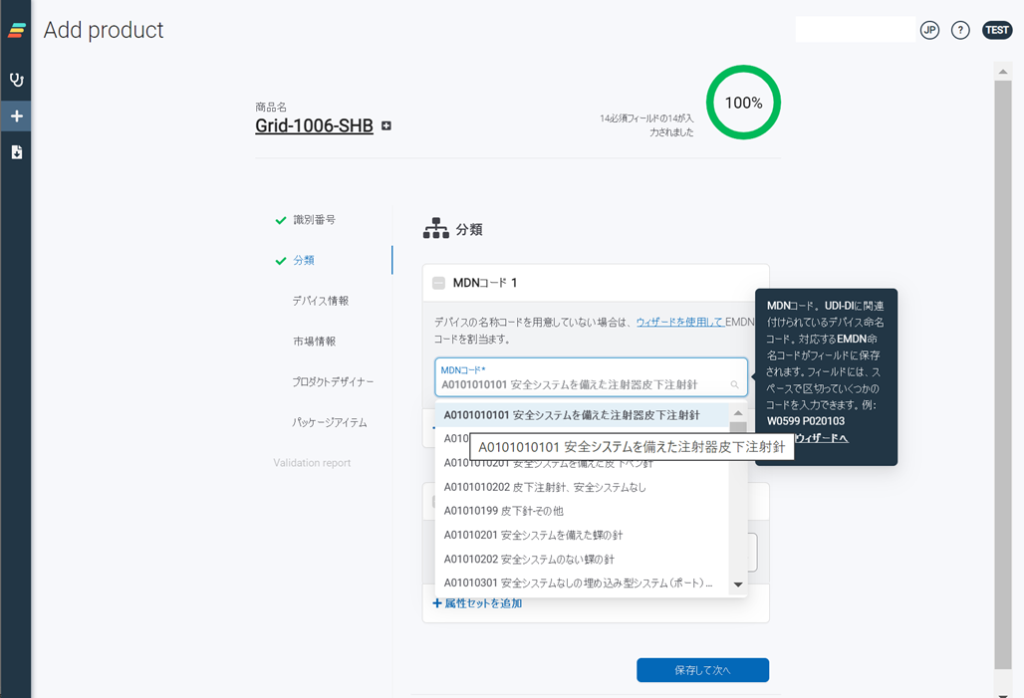
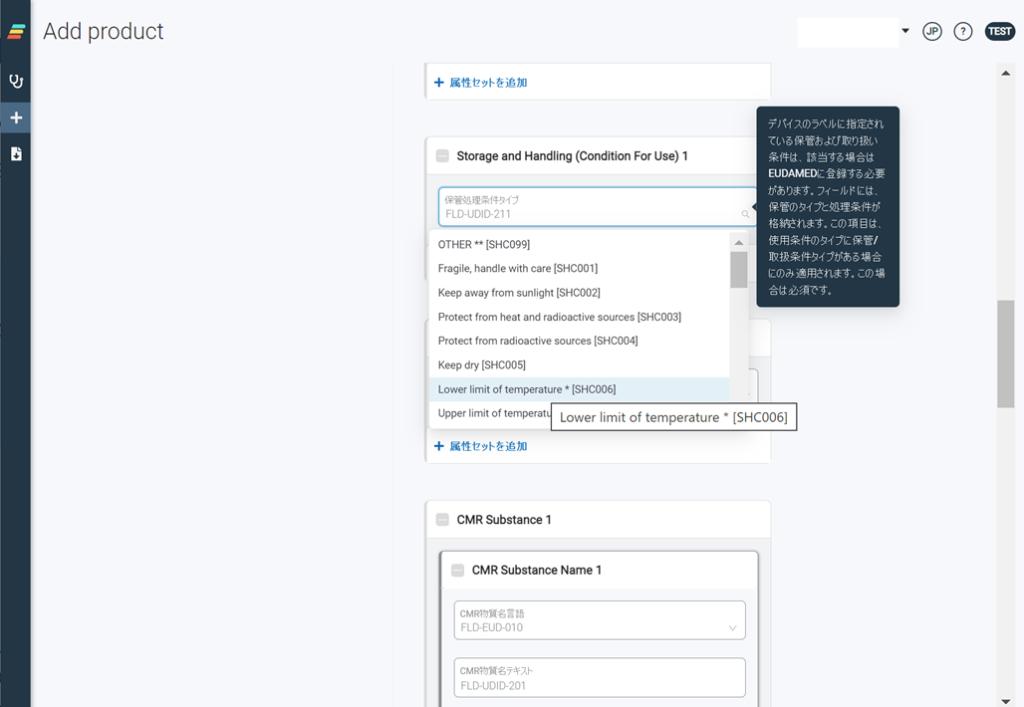
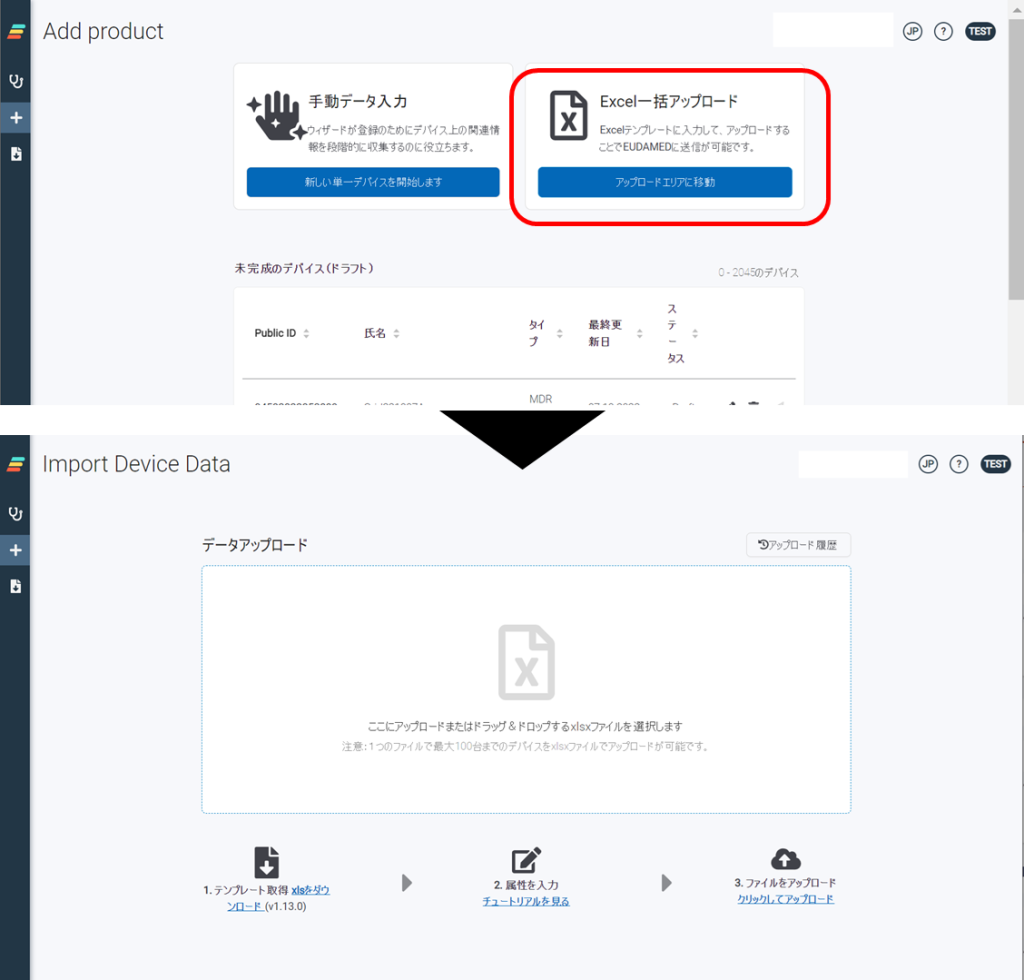
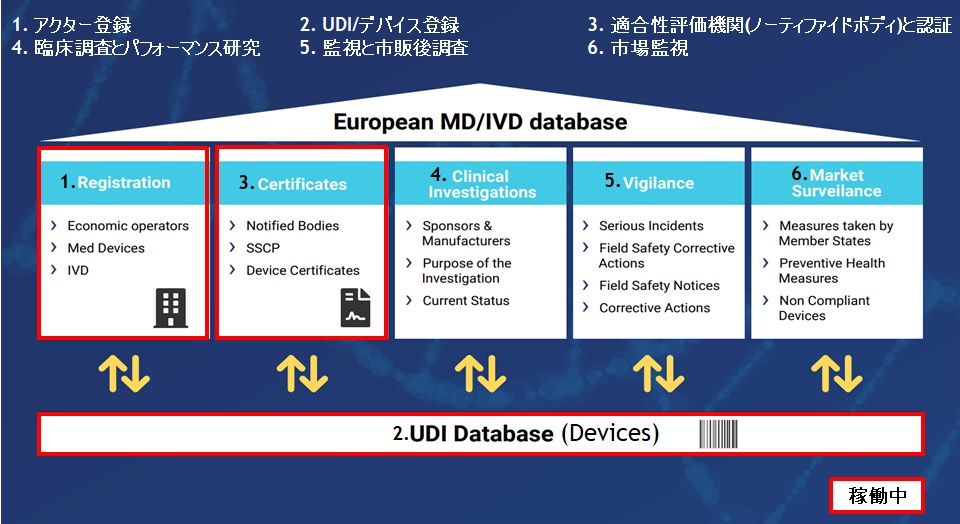
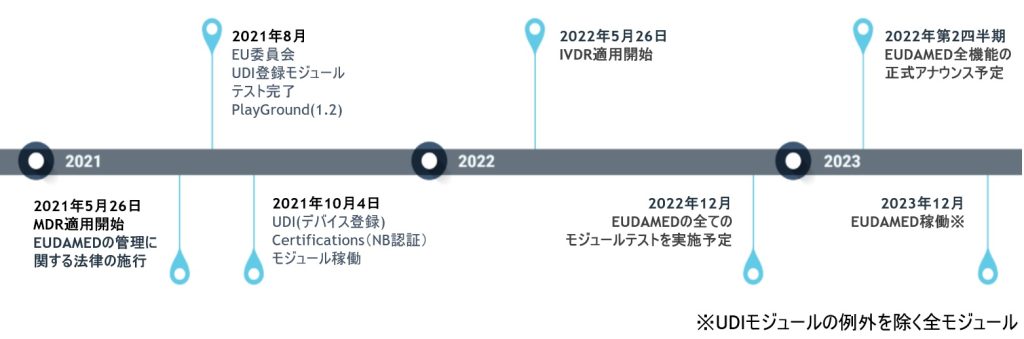
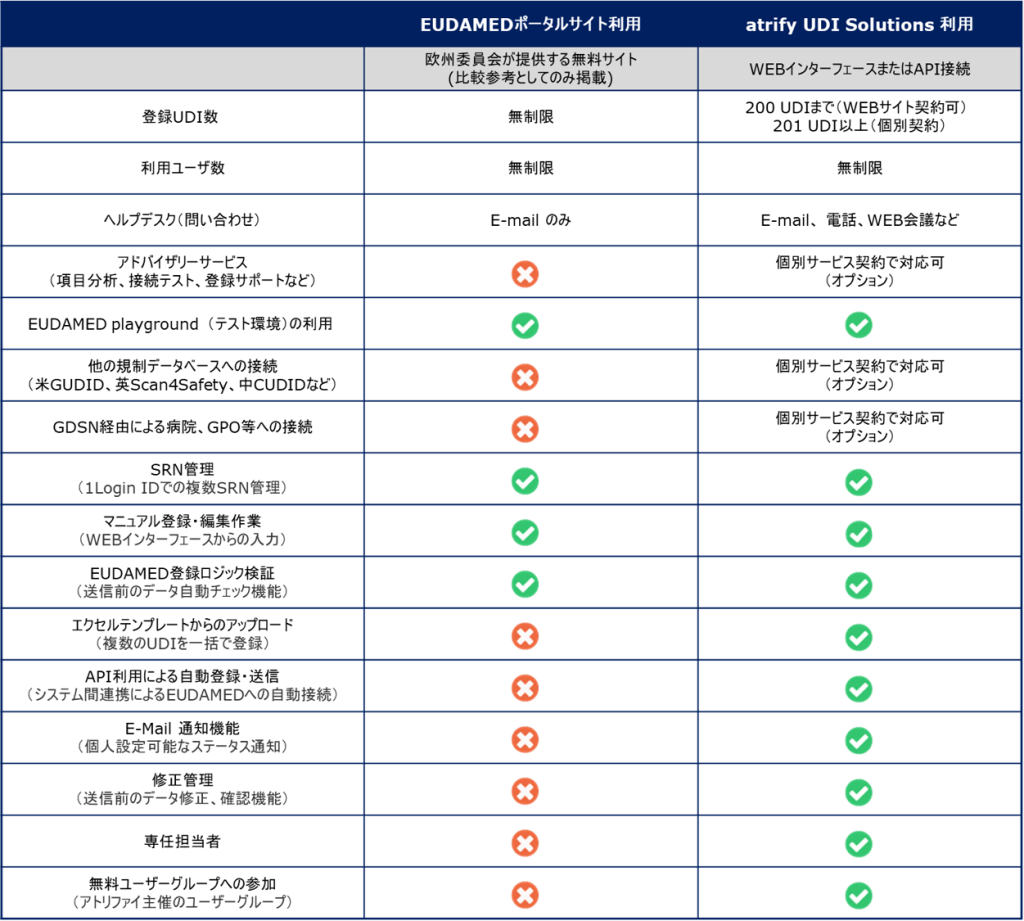
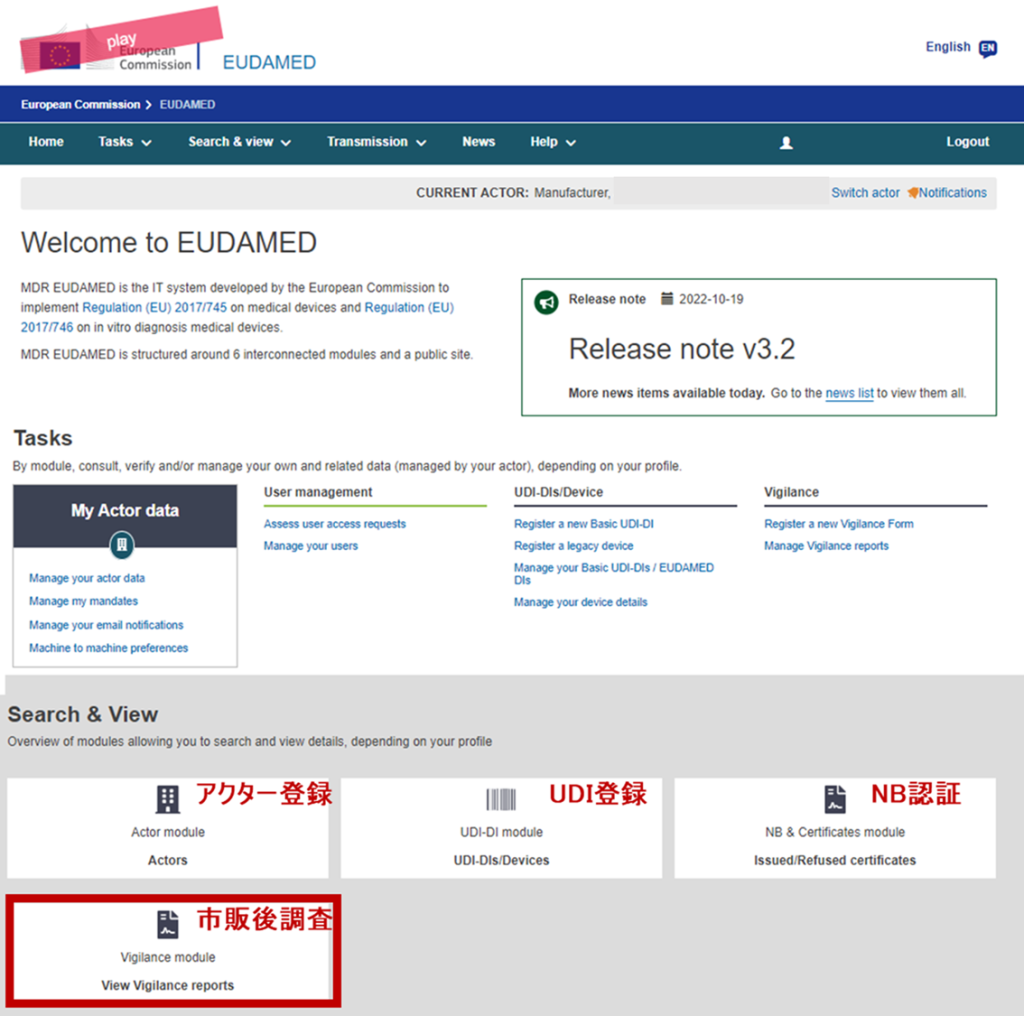
EUDAMEDは、6つのモジュール構成による複合型のシステム、データベースです。2022年11月の時点で、すでに3つのモジュール(アクター登録、UDI登録、NB認証)がリリースされております。残りの3つのモジュール
- 臨床調査とパフォーマンス研究(Clinical Investigations)
- 市販後調査(Vigilance)
- 市場監視(Market Surveillance)
の中で、EUDAMED導入プロジェクトが先行しているのが、「市販後調査(Vigilance)モジュール」です。EUDAMED Playground(テスト環境)では、すでにモジュールの存在が確認できます。
市販後調査(Vigilance)モジュールでの報告書作成及び報告タイミングは以下となります。Vigilanceモジュールから報告書を作成するには、事前にEUDAMED UDI登録モジュールにUDI-DI(Basic UDI-DI含む)データを登録しておく必要が生じる場合があります。
| クラス | 報告書種類 | 報告頻度 |
| Class I | PMSR (Post-Market Surveillance Report) 市販後調査報告書 | |
| Class IIa | PSUR (Periodic Safety Update Report) 定期的安全性最新報告書 | 2年に1回以上 |
| Class IIb | PSUR (Periodic Safety Update Report) 定期的安全性最新報告書 | 1年に1回以上 |
| Class III | PSUR (Periodic Safety Update Report) 定期的安全性最新報告書 | 1年に1回以上 |
◆Vigilanceモジュールに関する投稿はこちらからどうぞ◆
Vigilance(市販後調査)モジュール(2)・・・ PlaygroundサイトでのVigilanceモジュール