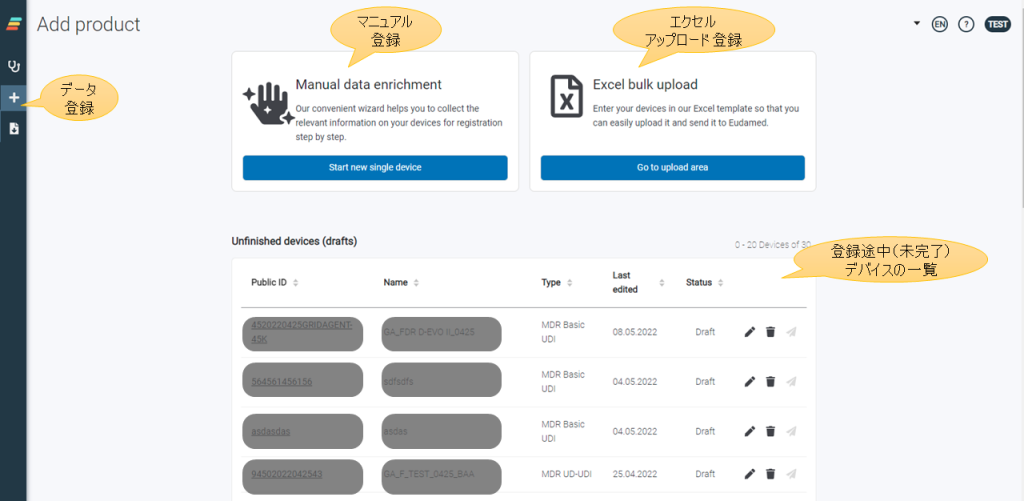
EUDAMEDにデバイスデータ(単品UDI-DI)を登録する際には、その上位概念となる「Basic UDI-DI」を紐づけて登録することが必須のため、「Basic UDI-DI」データを先に登録しておく必要があります。
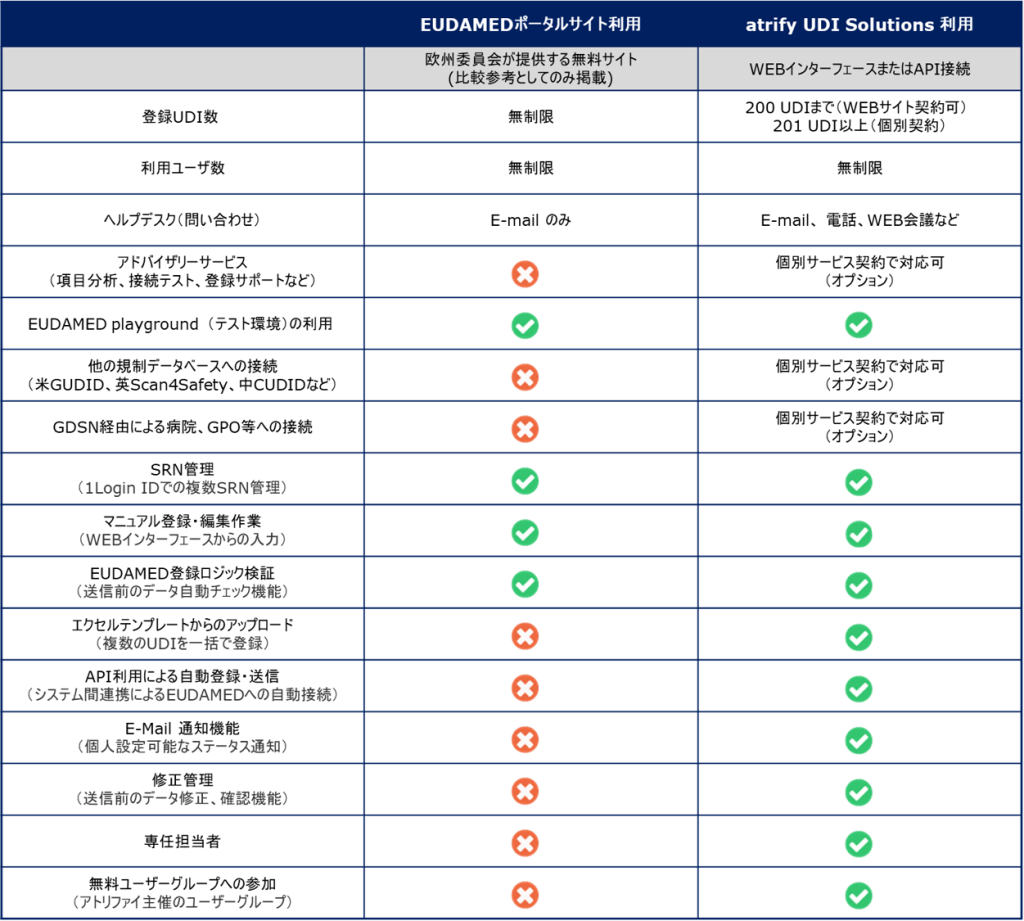
atrify UDI Managerのエクセルアップロード機能は、「Basic UDI-DI」と「UDI-DI」(単品、パッケージ階層なども)を同時に作成、アップロード、また、EUDAMEDへの送信・登録をワンステップで実行できる機能を備えています。
EUDAMEDのデータ項目には、データディクショナリ内の「Occurrence(発生)」という列で「Class Occurrence」(項目グループ単位)と「Attribute Occurrence」(FLD-UDID-XXXで定義される項目単位)で、
1・・・必須 1..n・・・必須で繰返し可 0..1・・・任意で繰返し不可 0..n・・・任意で繰返し可 がそれぞれ指定されています。Class Occurrennceとなる項目グループは、「Basic UDI-DI」を例にすると、Certificate(認証)関連の項目や、Clinical Investigation(臨床試験)関連の項目などが一括りの項目グループとして取り扱われます。
FLD番号 項目名 Class Attribute FLD-UDID-14 Basic UDI-DI Code なし 1 FLD-UDID-15 Authorised Representative なし 0..1 FLD-UDID-149 Nomenclature Code なし 1..n FLD-UDID-147 Annex XVI Non Medical Device Type なし 0..n FLD-UDID-60 Certificate Type 0..1 1 FLD-UDID-61 Certificate Number 0..1 0..1 FLD-UDID-51 Clinical Investigation Reference 0..n 1 FLD-UDID-300 Non EU Applicable Countries 0..n 0..n
Occurrenceの組み合わせ例 FLD-UDID-60、FLD-UDID-61は、Certificateグループ項目に属しています。このグループは、Class Occurrenceが「0..1」のため任意グループ項目となりますが、Certificate関連情報を登録する際(MDRではClass IIb または III、IVDRではClass B、C、D。それぞれに別途、条件があります。 )には、FLD-UDID-60は必須、FLD-UDID-61は任意で繰返し不可=一つだけ設定可という定義になります。
なお、MDR製品の「Basic UDI-DI」項目は大きく分けて4つのセグメントから構成されています。
Keydata・・・Basic UDI-DI、SRN番号、AR番号、名称、デバイスタイプなどの基本的な情報 Model data・・・製品の特性に関する情報(YES(True)/NO(False)で設定する項目) Certificate information・・・認証機関に関する情報 Clinical investigation・・・臨床試験に関する情報 IVDR、システム/プロシジャーパックでは、設定するデータ項目が若干異なるため注意が必要となります。これらの4つのセグメントのデータ項目の条件を満たせれば、「Basic UDI-DI」データの登録は完了します。EUDAMED本番(Production)環境へのデータ登録は、事前にテストサイト(EUDAMED PlayGround)環境で十分なテストを実施した上で登録することを推奨しております。
EUサイトにUDIデータの登録ステップの流れを説明した資料があります。
https://ec.europa.eu/health/system/files/2021-11/md_eudamed-udi-registration-process_en_0.pdf
◆Basic UDI-DI 関連投稿はこちらからどうぞ◆
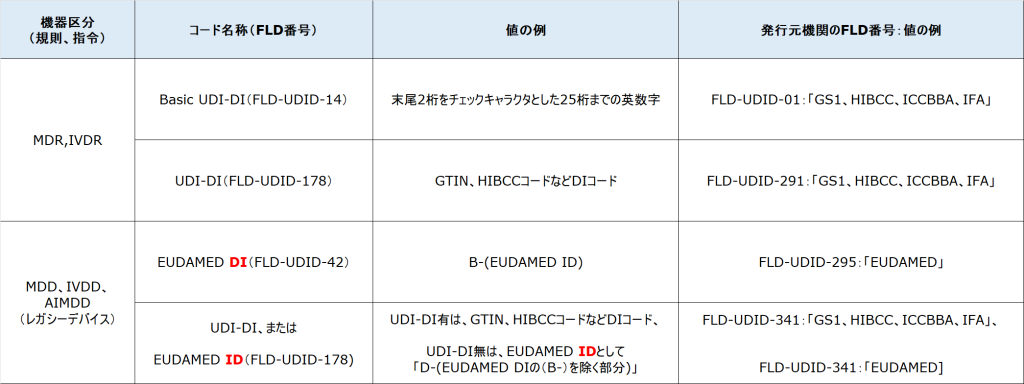
Basic UDI-DI(1) ・・・ Basic UDI-DIとは、どんなコードなのか
Basic UDI-DI(2) ・・・ Basic UDI-DIの発行元機関(Issuing Entity)について
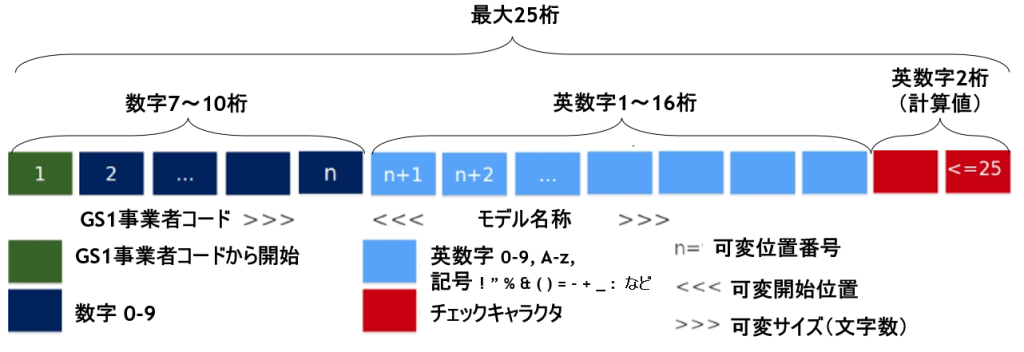
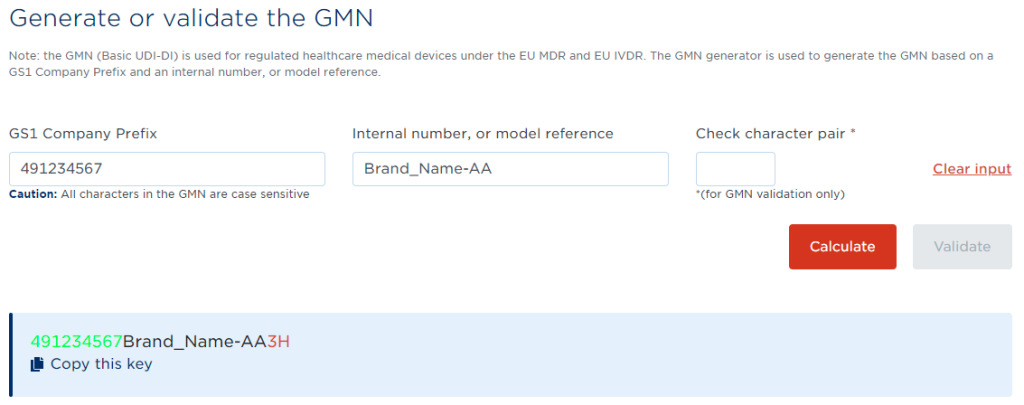
Basic UDI-DI(3) ・・・ 発行元機関をGS1とした場合のBasic UDI-DIの例
Basic UDI-DI(5) ・・・ Certificate(認証)関連データ項目の登録有無について
Basic UDI-DI(6) ・・・ レガシーデバイスにおけるBasic UDI-DIの値について