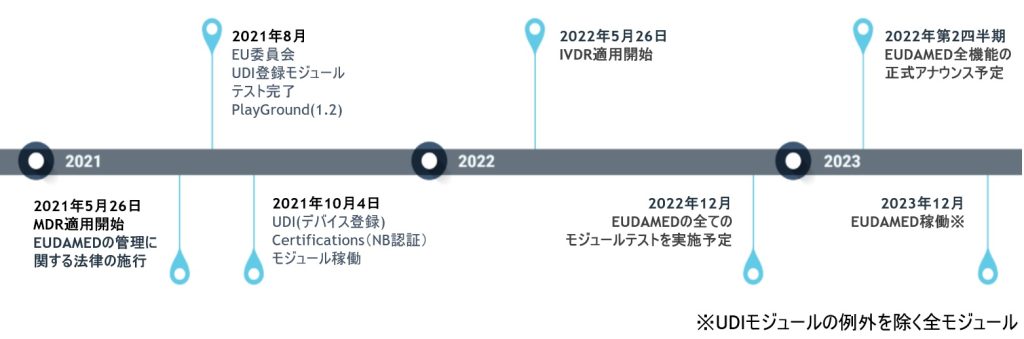
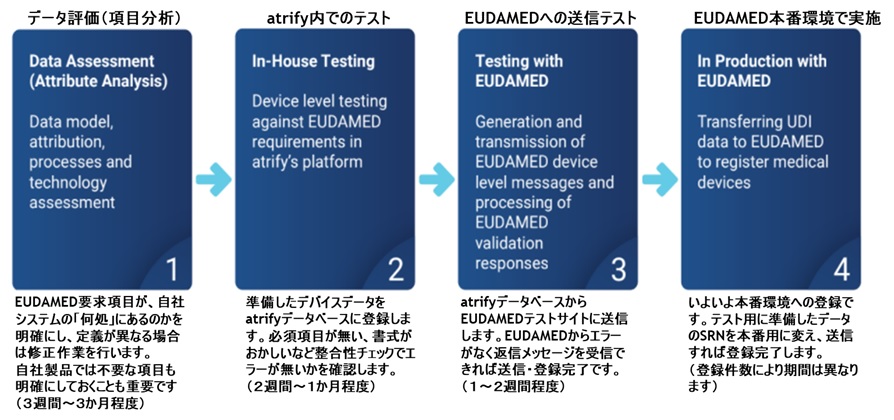
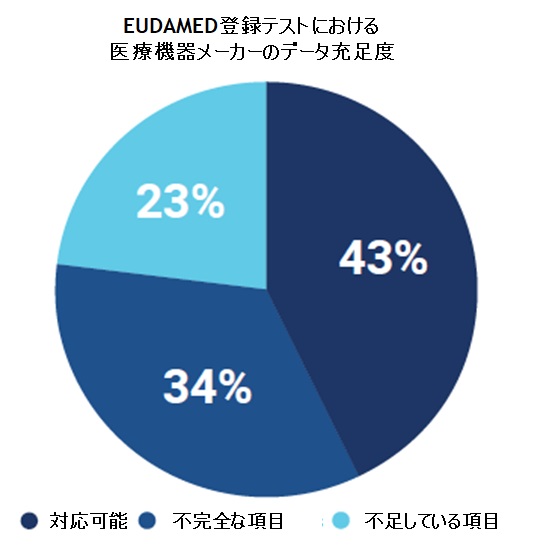
アトリファイのユーザー企業は、初めに項目分析サービス(atrify Attribute Analysis)を実施していだきます(有償サービス)。この作業では、貴社のEUDAMED登録データ(MDR、IVDR、Legacyなど)を明確にし、EUDAMEDが要求する項目の中で、登録に必要な項目が何であるかを正確に把握するところから始まります。
また、各要求項目に入力する値が、すでに自社システム内、ラベルなどに存在しているのかの有無や、無かった場合に、どのような値をセットするのかなどを、各項目の対応について1項目ごと丁寧に検証していきます。作業は貴社製品をサンプルとして実施するため、完了時には、テスト登録に必要なデータが揃っています。(アトリファイではMDR/IVDR/Legacy、Class別にそれぞれ貴社のご要望に応じて対応しています)
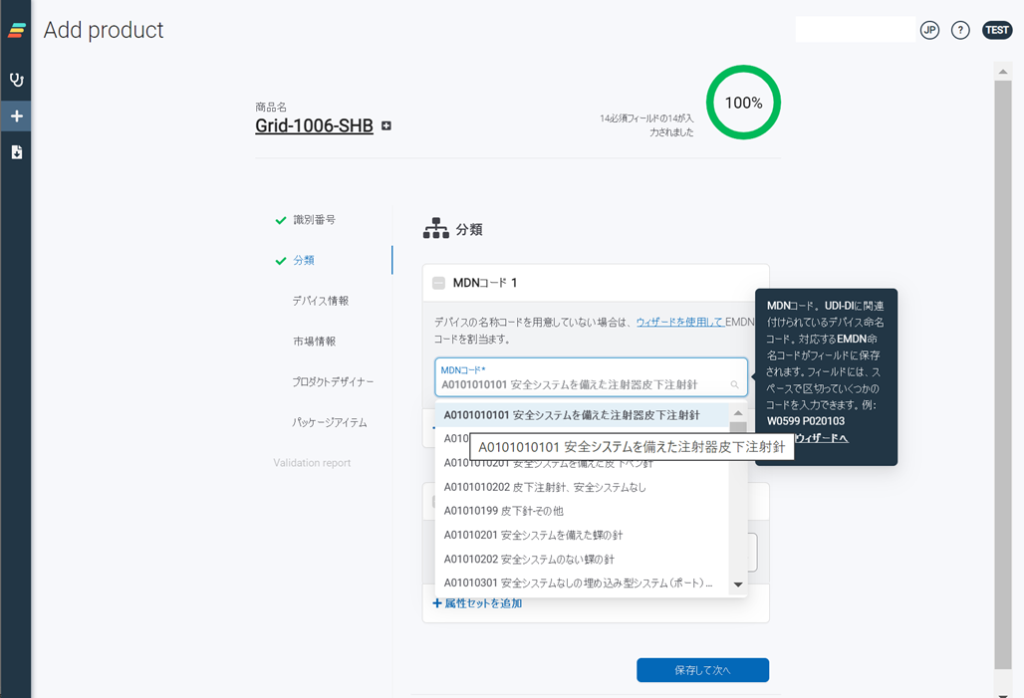
テストデータが揃った段階で、第2ステップのアトリファイデータベースへの登録・確認作業となります。atrify UDI DBに組み込まれた整合性チェック機能を通じて登録項目にエラーがないかどうかをチェックします。この段階では、
必須項目にデータが入っているかどうか? 選択肢項目(Enum Valid Values)に選択値がセットされているのかどうか? 繰り返し項目が正しく設定されているのかどうか? などをチェックします。
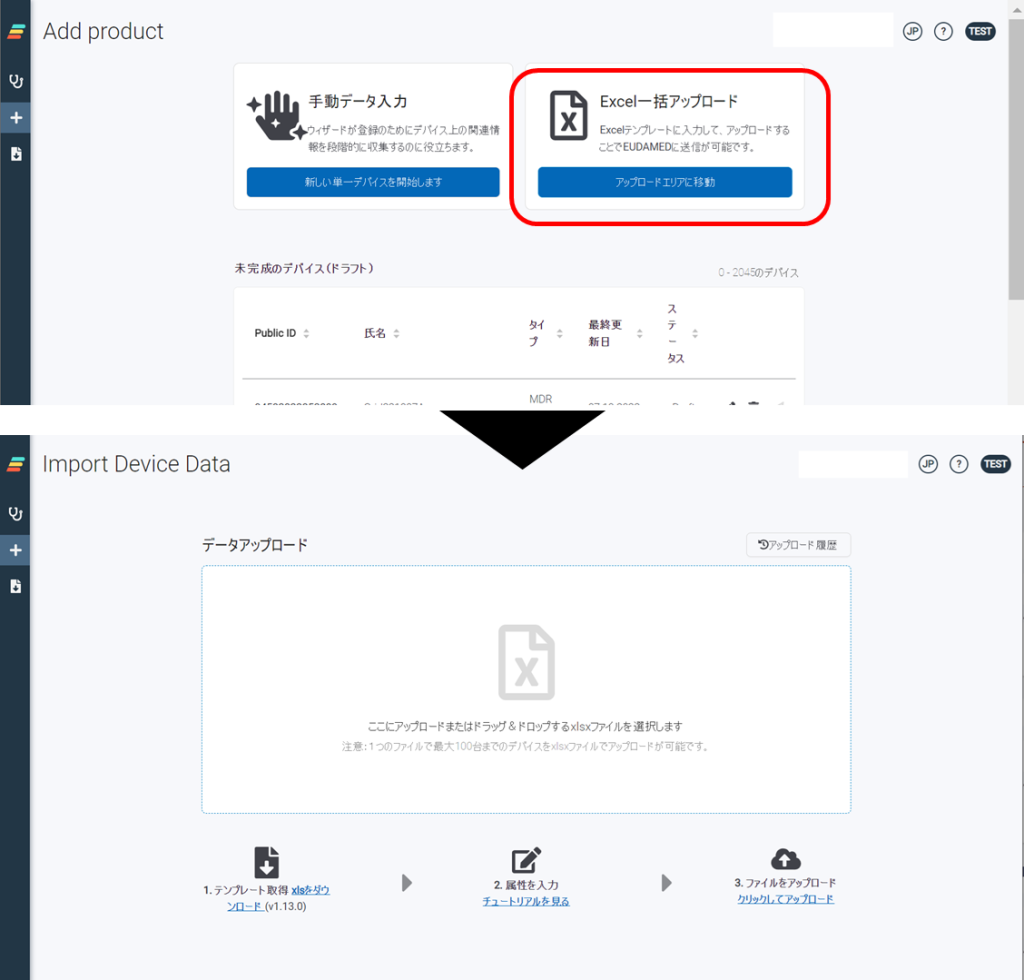
atrify UDI DBへのデータ登録は、
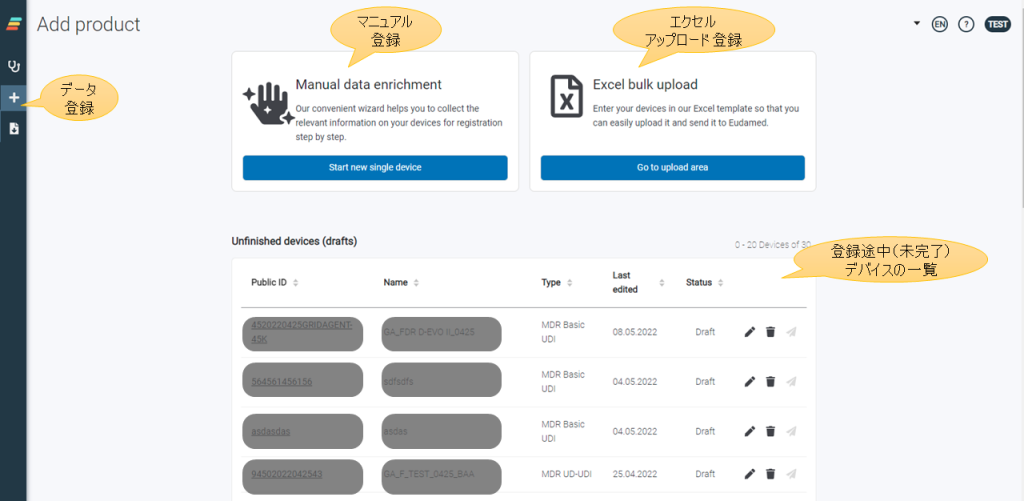
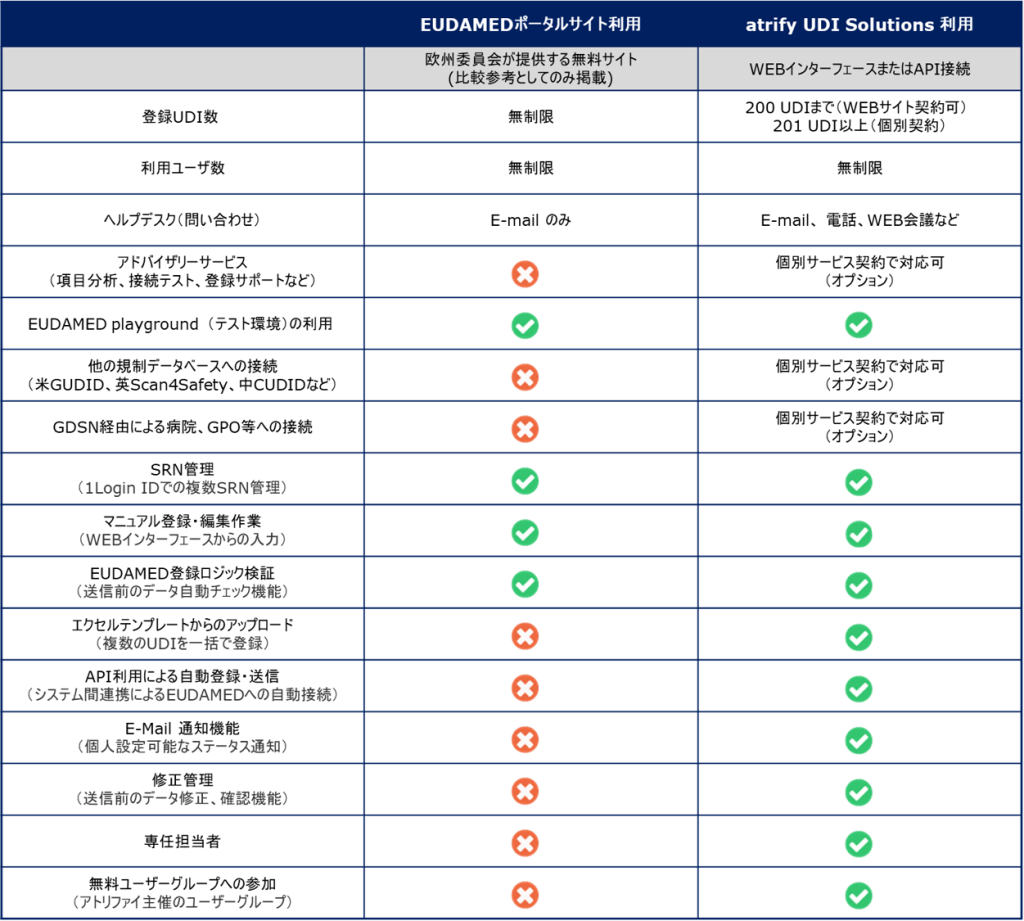
atrify UDI Mananger からのマニュアル入力(1件ずつの手入力作業) atrify UDI Mananger へエクセルテンプレートを利用したアップロード(複数アイテムの一括登録が可能) atrify UDI Connector(APIを利用し、貴社システムとアトリファイシステムを接続したデータ転送方式(M2M接続)) の3つの方法から登録できます。
第3ステップでは、atrify UDI データベースに登録したテストデータをEUDAMEDテスト環境(Playground)に送信し、EUDAMED側の最終チェックを受けます。データに問題があればエラーが瞬時に返ってきます。登録可能な場合は、「Submitted」または「Registered」の返信とともにEUDAMEDに登録されます。充分なテストを経験したのち、第4ステップのプロダクション(本番)環境への登録を行います。
【データ登録・送信の際の注意点】
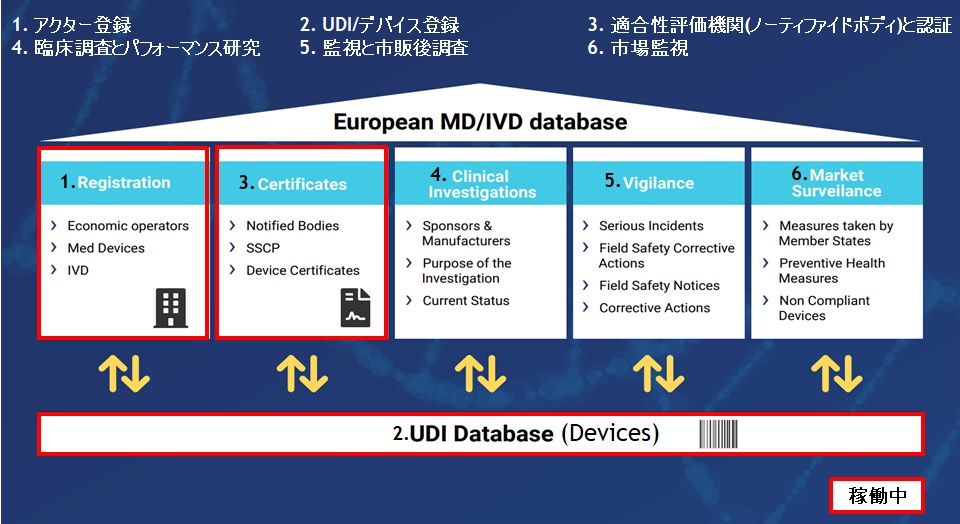
テスト環境用のSRNとプロダクション環境用のSRNは異なります。欧州代理人(AR)のSRNも異なります。 EUDAMEDでは、一旦登録した後では修正不可の項目が多数あります。また修正可能な項目でも空白(ブランク)の場合のみ追加可能で、値がある場合の修正は不可の項目もあります。 Basic-UDI、UDI-DI、パッケージDIをそれぞれ関連付けて登録するため、登録方法によっては変更も削除もできなくなる場合があります。 UDIデバイス登録したデータは、他モジュール(NB認証、ヴィジランスなど)で参照されますので他モジュール利用の際にはUDIデバイス登録が必須となります。NB側からMDR/IVDRの認証をするのにEUDAMEDへUDIデバイス登録が必要との要請を受ける場合があります。