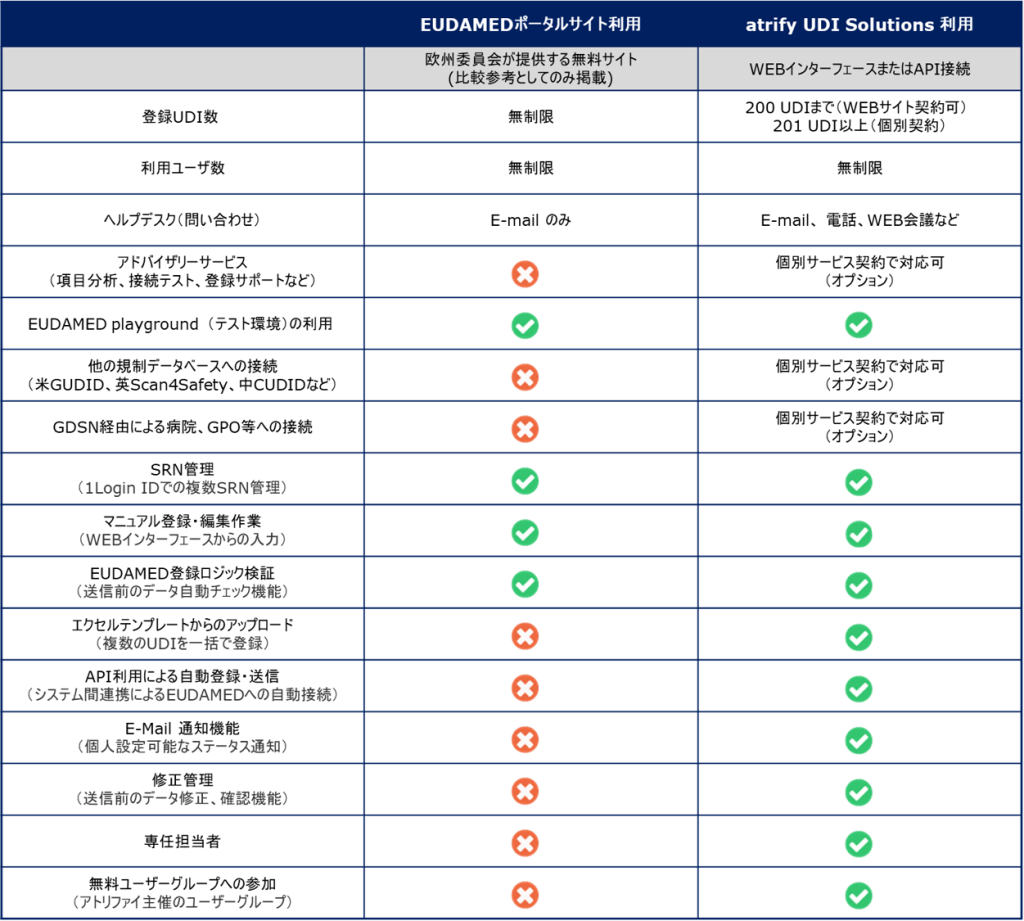
atrify社ではEUDAMEDへのUDIデータ登録方法として、以下の3つの機能を提供しています。
- atrify UDI Mananger からのマニュアル入力(1件ずつの手入力作業)
- atrify UDI Mananger へエクセルテンプレートを利用したアップロード(複数アイテムの一括登録が可能)
- atrify UDI Connector(APIと利用し、貴社システムとアトリファイシステムを接続したデータ転送方式(M2M接続))
atrify UDI Connectorの接続方式の実現には、システム間の接続作業など登録作業以外の事前設定が必要となります。日本のお客様の多くは、ユーザー部門で登録作業を完結できる「atrify UDI Manager」 を利用し、EUDAMEDへのUDIデータ登録作業を実施しています。

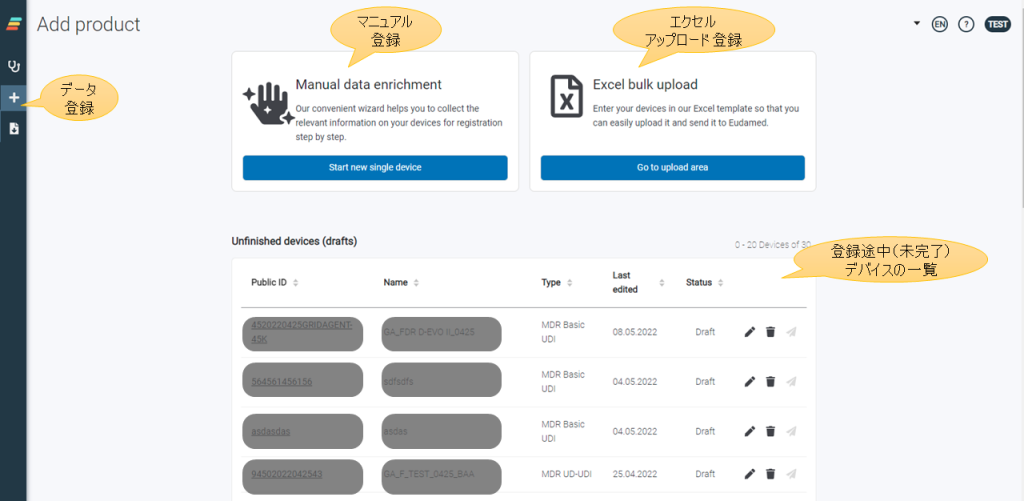
atrify UDI Managerは、WEBブラウザのインターフェースにて提供され、主な機能として、
- データ項目の入力(またはエクセルアップロード)
- EUDAMEDへの送信と登録完了確認(エラーの場合は、エラーメッセージ)
- 入力データ(未登録、登録済)の検索
- 入力データ(未登録、登録済)一覧表示、ステータス確認
- データダウンロード(一覧リスト、個別デバイス)
- メール通知
等を備えています。データ登録の際には、機器のデータタイプ(MDR、IVDR、レガシー、SPP)を選択し、入力方法(マニュアルまたはエクセルアップロード)を決めて作業を行います。作業途中のデータについては、保存した状態から作業を再開することもできます。